时间:2017-11-05 23:49:42
1、选择题 常温下,关于下列溶液的叙述错误的是( )
A.pH=3的弱酸溶液和pH=11的强碱溶液等体积混合后溶液呈酸性
B.pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10
C.向1L0.3mol/L的NaOH溶液缓缓通入CO2气体至溶液增重8.8g,则2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
D.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则c[(NH4)2SO4]>c[(NH4)2CO3]>c[(NH4)2Fe(SO4)2]
参考答案:A、pH=3的弱酸中c(H+)=10-3mol/L,pH=11的强碱中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于弱酸为弱电解质,不能完全电离,则弱酸浓度大于强碱浓度,反应后弱酸过量,溶液呈酸性,故A正确.
B、硫酸是强电解质,PH=5的硫酸溶液中硫酸根离子的物质的量浓度=5×10-6mol/L,当溶液稀释500倍后,硫酸根离子的物质的量浓度是用来的1500,所以硫酸根离子的物质的量浓度=1×10-8 mol/L,溶液接近于纯水,所以氢离子以水电离的为主,接近于10-7 mol/L,所以稀释后溶液中c(SO42-)与c(H+)之比约为1:10,故B正确.
C、溶液增重8.8g时,溶液吸收的质量是二氧化碳的质量,二氧化碳的物质的量=8.8g44g/mol=0.2mol,氢氧化钠的物质的量是0.3mol,当氢氧化钠与二氧化碳的物质的量之比为1:1时生成碳酸氢钠,当氢氧化钠和二氧化碳的物质的量之比为2:1时生成碳酸钠,实际上氢氧化钠和二氧化碳的物质的量之比=0.3:0.2=3:2,所以生成的有碳酸钠和碳酸氢钠,根据碳原子守恒知n(HCO3-)+n(CO32-)+n(H2CO3)=0.2mol,溶液中n(Na+)=0.3mol,所以2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)],故C正确.
D、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2都是含有弱根离子的盐,都能发生水解反应; (NH4)2SO4中只有铵根离子水解,(NH4)2CO3中铵根离子和碳酸根离子相互促进水解,(NH4)2Fe(SO4)2中铵根离子和二价铁离子相互抑制水解,所以c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则c[(NH4)2CO3]>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2],故D错误.
故选D.
本题解析:
本题难度:一般
2、选择题 25°C时某些弱酸的电离平衡常数如下表,下列说法正确的是(? )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
参考答案:BC
本题解析:相同温度下,根据表格中给出的3种弱酸的电离常数进行比较,可知相同条件下酸性强弱顺序为CH3COOH>H2CO3>HClO,A错误;其对应的强碱盐水解呈碱性,根据越弱越水解规律可知,相同条件下水解程度Na2 CO3>NaClO>NaHCO3>CH3COONa,所以B正确;根据物料守恒,等物质的量浓度的NaClO和NaHCO3 混合溶液中c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3),C正确;因为碳酸酸性强于次氯酸,而HCO3-酸性弱于次氯酸,所以根据强酸值弱酸原理,向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:ClO—+CO2+H2O=HCO3—+HClO,D错误;故选BC。
本题难度:一般
3、选择题 下列事实一定能说明HNO2为弱电解质的是( )
①常温下NaNO2溶液的PH>7?
②10mL1mol/L?HNO2恰好与10mL1mol/LNaOH完全反应
③HNO2与NaCl不能反应
④0.1mol/L?HNO2溶液的PH=2.1.
A.:①②③④
B.:②③④
C.:①④
D.:②④
参考答案:①常温下NaNO2溶液,根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,如果NaNO2是强酸强碱盐,PH=7,而题干中PH>7,说明NaNO2为强碱弱酸盐,故①正确;
②10mL1mol/L?HNO2恰好与10mL1mol/LNaOH完全反应,HNO2和NaOH的物质的量都为0.01mol,无论亚硝酸是强酸还是弱酸,它和氢氧化钠正好1:1反应,与酸是否强弱无关,故②错误;
③HNO2与NaCl不能反应,无论亚硝酸是强酸还是弱酸,它们间都不反应,故③错误;
④0.1mol/L?HNO2溶液的PH=2.1.如果亚硝酸是强酸,0.1mol/L?HNO2溶液的PH应该等于1,而此时PH=2.1,说明电离出的氢离子浓度小,说明HNO2为弱电解质,故④正确;
故选C.
本题解析:
本题难度:一般
4、填空题 (16分)醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
| a | 298 | 0.20 | | I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究来源:91考试网 91ExaM.org 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
| b | 308 | 0.20 | | |
| c | 298 | 0.40 | | |
| d | | | |
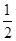 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1 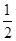 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。参考答案:(1) 1.3×10-3 (1分);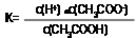 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L(3分)
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L(3分)
(2) ①Ⅰ、温度(1分) II、不同浓度 (1分) d. 298 (2分) 0.20(2分)
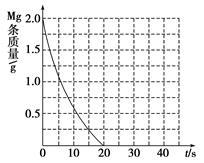
②见下图(4分,每条曲线2分,不标注共扣2分,曲线趋势错、终点错不给分)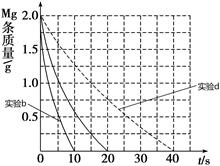
(3) Mg(OH)2(s)===MgO(s)+H2O(g) ΔH=+81 kJ/mol.(2分)
本题解析: (1)某醋酸溶液中c(CH3COOH)=0.10mol/L,CH3COOH  CH3COO-+ H+;c(H+)=" 1.3×" 10-3mol/L ,则此时c(CH3COO-)= c(H+)=1.3×10-3mol/L;此时醋酸的电离平衡常数
CH3COO-+ H+;c(H+)=" 1.3×" 10-3mol/L ,则此时c(CH3COO-)= c(H+)=1.3×10-3mol/L;此时醋酸的电离平衡常数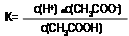 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L(2)①Ⅰ、反应的其他条件相同,而温度不同,因此实验a和b是探究温度对镁与盐酸反应速率的影响;II.实验a和c的温度相同we盐酸的浓度不相同,因此实验a和c是探究浓度对镁与盐酸反应速率的影响;III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,所以实验d的反应温度是298,盐酸与醋酸的浓度0.20mol/L;②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,则在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线如下图,
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L(2)①Ⅰ、反应的其他条件相同,而温度不同,因此实验a和b是探究温度对镁与盐酸反应速率的影响;II.实验a和c的温度相同we盐酸的浓度不相同,因此实验a和c是探究浓度对镁与盐酸反应速率的影响;III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别,所以实验d的反应温度是298,盐酸与醋酸的浓度0.20mol/L;②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,则在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线如下图,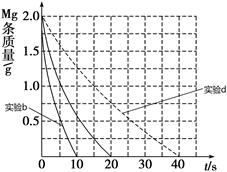 。(3)②+③-①,整理可得:Mg(OH)2(s)===MgO(s)+H2O(g) ΔH=+81 kJ/mol。
。(3)②+③-①,整理可得:Mg(OH)2(s)===MgO(s)+H2O(g) ΔH=+81 kJ/mol。
考点:考查弱电解质的电离平衡、电离平衡常数的计算、影响速率的各种因素的图像法表示、盖斯定律的应用、热化学 的书写的知识。
本题难度:困难
5、选择题 下列溶液中酸性最强的是(?)
A.pH="4.5"
B.C(H+)=10-4 mol·L-1
C.C(OH-)=1×10-8 mol·L-1
D.加入甲基橙变红的溶液
参考答案:D
本题解析:根据pH定义,B项pH=4,C项pH=6,D项变色范围pH在3.1以下,故选D项。
本题难度:一般