时间:2017-11-05 23:48:32
1、选择题 标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是
A.所得沉淀为0.05 mol的BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672<a<0.896
2、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
?
A.50mL烧杯
B.50mL量筒
C.25mL碱式滴定管
D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
3、填空题 已知:A是硫酸盐,且A和G、C和D、F和H元素组成相同。G和KSCN溶液混合后溶液显血红色。反应过程中产生的水在图示中已略去。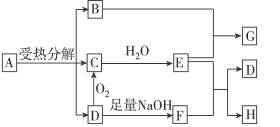
完成下列问题:
(1)写出G和H的化学式:G_____________,H_____________。
(2)工业生产中D转化为C的反应条件是:_____________。
(3)B跟E反应的离子方程式是_____________。
4、选择题 在O2中灼烧0.44g硫和铁组成的化合物,使其中的硫全部变为SO2,把这些SO2全部转化为H2SO4,这些H2SO4可以用20mL0.5 mol/L的NaOH溶液完全中和,则原化合物的化学式为?
A.FeS
B.FeS
C.Fe2S3
D.Fe3S4
5、填空题 实验室为了防止FeCl2溶液变质,通常向该溶液的试剂瓶中加入适量的?粉,取适量FeCl2溶液于试管中,滴入适量的NaOH溶液产生?色絮状沉淀,继而迅速的变为?色,最后变为?色的?(写化学式)沉淀。