时间:2017-11-05 22:49:28
1、填空题 (10分)工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是_____________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是____________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
参考答案:(1)不能 因Fe2+沉淀时的pH最大,Fe2+完全沉淀时的Cu2+、Fe3+早已沉淀
①A ②不妥当 引入了新杂质Na+ ③CD (2)C
本题解析:
(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成;
①NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大;
②加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质;
③为避免引入杂质,浓HNO3和KMnO4不能选用,可以用Cl2或O2氧化除去Fe2+;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则可用CuO 或Cu(OH)2或CuCO3或Cu2(OH)2CO3。
考点:考查常见的氧化剂、溶液的除杂
点评:本题考查了常见的氧化剂、溶液的除杂,难度不大。解题时应注意选择除杂试剂时,应保证不能引入新的杂质。
本题难度:困难
2、选择题 为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是
A.NaOH
B.Na2CO3
C.氨水
D.MgO
参考答案:D
本题解析:选项A、B、C中都能引入新的杂质,不正确。氧化镁能消耗溶液中的氢离子,减弱溶液的酸性,所以可以生成氢氧化铁沉淀而除去,且不会引入杂质,答案选D。
考点:考查物质的分离和提纯。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
3、填空题 (14分)(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |

参考答案:(Ⅰ)(1)K1·K2(2分); >(2分)
(2)加入催化剂(2分);将容器的体积(快速)压缩至2L(2分,仅答加压的给1分)
(3) ×10-7(2分)
×10-7(2分)
(Ⅱ)(1)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2分)
(2)21%。(2分)
本题解析:(Ⅰ)(1)反应①的平衡常数表达式K1=[CH3OH]/[CO][H2]2,反应②的平衡常数表达式K2="[CO]" [H2O]/[CO2][H2],反应③的平衡常数表达式K3=[CH3OH] [H2O]/[CO2][H2]3,则K3= K1·K2。500℃时反应③的平衡常数K3= K1·K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, Q=(0.3×0.15)÷(0.8×0.1)=0.5625,Q<K,反应正向进行,则此时V正>V逆。(2)对于反应②:在t0时刻改变一个条件,曲线Ⅰ变为曲线Ⅱ,由图像可知平衡时c(CO)不变,说明平衡没有移动,但缩短了达平衡的时间,改变的条件为加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO的平衡浓度由3.0mol/L迅速变为4.5 mol/L,反应在3 L容积可变的密闭容器中发生,且该反应两边气体物质的系数相等,则改变的条件为将容器的体积(快速)压缩至2L。(3)醋酸的电离方程式为CH3COOH  CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为
CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为 ×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。
×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。
考点:考查化学反应速率和化学平衡,溶液中的离子反应及相关计算。
本题难度:困难
4、填空题 明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____________能力。设计一个简单实验验证明矾溶于水发生了水解 。
参考答案:27.吸附 用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性
本题解析:明矾净水的原理是铝离子能水解Al3++3H2O Al(OH)3 +3H+,水解产生的氢氧化铝具有吸附能力,吸附水中悬浮物,明矾水解显酸性,要证明明矾发生了水解,只要证明溶液呈酸性就行,操作方法为:用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性,明矾发生了水解。
Al(OH)3 +3H+,水解产生的氢氧化铝具有吸附能力,吸附水中悬浮物,明矾水解显酸性,要证明明矾发生了水解,只要证明溶液呈酸性就行,操作方法为:用PH试纸或PH计测试明矾溶液,pH < 7 证明溶液呈酸性,明矾发生了水解。
考点:考查盐的水解等知识。
本题难度:一般
5、选择题 下列物质能发生消去反应且只能得到一种单烯烃的是( ? )
A.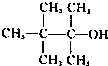
B.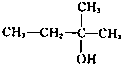
C.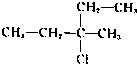
D.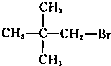
参考答案:A
本题解析:
本题难度:简单