时间:2017-11-05 22:43:36
1、选择题 已知1 mol NaOH与HCl完全反应放出57.4 kJ的热量。下列热化学方程式书写正确的是( )
A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+28.7 kJ/mol
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-28.7 kJ/mol
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol
参考答案:D
本题解析:中和反应是放热反应,所以AC不正确;B不正确,反应热的数值不正确,答案选D。
本题难度:一般
2、选择题
A.K>KW
B.K=KW
C.K<KW
D.无法比较
参考答案:A
本题解析:将纯硫酸类比于水找出纯硫酸的电离平衡是解此题的关键。
类比于水,纯硫酸的电离平衡可定为:H2SO4+H2SO4 H3SO
H3SO +HSO
+HSO
则其离子积常数KW=c(H3SO )·c(HSO
)·c(HSO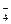 )。根据题意,纯硫酸的导电性强于水,则可粗略地认为硫酸中离子浓度大于纯水中离子的浓度,即K>KW。
)。根据题意,纯硫酸的导电性强于水,则可粗略地认为硫酸中离子浓度大于纯水中离子的浓度,即K>KW。
本题难度:简单
3、填空题 我国目前使用最多的燃料是煤、石油、天然气,它们都是 燃料.造成环境污染的SO2,主要是燃烧 产生的,它与空气中的水蒸气结合可以变成 ,随雨降到地面,会使土壤 ,而伤害农作物。
参考答案:化石 煤 酸雨 酸化
本题解析:煤、石油、天然气都是有古代生物转变而成的,属于化石燃料;天然气主要成分是CH4,燃烧后生成CO2和H2O;石油由多种碳氢化合物组成的混合物,燃烧后主要产物CO2和H2O;煤是由有机物和少量无机物组成的复杂混合物,其组成以碳元素为主,还含有少量氢、氧、氮、硫等元素,燃烧后产生SO2,污染空气,产生酸雨,会使土壤酸化。
考点:考查环境污染等相关知识。
本题难度:一般
4、选择题 用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.盛装标准液的滴定管未用标准液润洗
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡
参考答案:D
本题解析:A.未用标准液润洗碱式滴定管,导致NaOH溶液的浓度偏低,导致消耗NaOH溶液的体积过大,所以最终结果浓度偏高
B.仰视滴定管读数偏高,所以结果偏高
C. 锥形瓶不可润洗,由于盐酸的物质的量多了,所以结果偏高
D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡,说明氢氧化钠读数偏小,所以最终结果浓度偏低。
故选D
点评:掌握中和滴定过程误差分析原理(考虑所消耗的标准溶液体积受到哪些影响)。
本题难度:一般
5、选择题 下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
C. 1.0×10-3 mol/L盐酸的pH=3.0, 1.0×10-8 mol/L盐酸的pH=8.0
1.0×10-3 mol/L盐酸的pH=3.0, 1.0×10-8 mol/L盐酸的pH=8.0
D.若1mLpH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
参考答案:D
本题解析:略
本题难度:一般