时间:2017-11-05 20:42:10
1、选择题 自然界中存在一种尖晶石,化学式为MgAl2O4,它晶莹剔透,非常美观,可以作为宝石。已知该尖晶石中混有一定量的Fe2O3。取来源:91考试网 www.91eXam.org该矿石粉末样品11.36 g,恰好能与200 mL一定浓度的盐酸反应,则该盐酸的浓度可能是( )
A.2.00 mol·L-1
B.2.80 mol·L-1
C.3.30 mol·L-1
D.3.50 mol·L-1
2、计算题 (6分)铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0价、+1价、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜〔即:曾青(CuSO4)跟铁反应生成铜〕,试写出该反应的离子方程式:____________________________________。
(2)尽管铜比铁较为稳定,但铜器表面经常会生成铜锈〔即:铜绿,化学式Cu2(OH)2CO3〕,其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:________________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)
3、填空题 (12分)⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__?g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: ?2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
①?当 a / b =1时,_______________________?______;
②?当a / b≥3/2时,________________?_____________。
⑶观察如下反应,总结规律,然后完成下列问题:
①?Al(OH)3 +H2O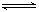 Al(OH)4- + H+? ②NH3+H2O
Al(OH)4- + H+? ②NH3+H2O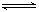 NH4+?+ OH_
NH4+?+ OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式________________________?__
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式___________?_________________
4、选择题 将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量变轻的是 (? )
A.饱和澄清石灰水
B.稀硫酸
C.乙醇
D.食盐水
5、实验题 工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下: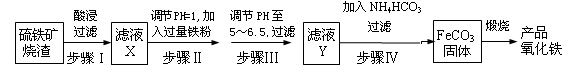
试回答下列问题:
(1)滤液X中含有的金属阳离子是?(填离子符号)。
(2)步骤Ⅲ中可选用?试剂调节溶液的pH(填字母)。
A.稀硝酸
B.氨水
C.氢氧化钠溶液
D.高锰酸钾溶液
(3)过滤操作中除了玻璃棒、烧杯还需要的玻璃仪器是?。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是?。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为?。