时间:2017-11-05 20:42:10
1、选择题 足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
A.①②
B.②③
C.③④
D.①④
参考答案:B
本题解析:CO还原铁的氧化物生成CO2,CO2与氢氧化钙反应生成碳酸钙,即25g是碳酸钙的质量,物质的量=25g÷100g/mol÷0.25mol。则根据原子守恒可知CO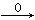 CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
本题难度:简单
2、实验题 (6分)砖瓦是用含铁元素等杂质的黏土隔绝空气烧制成,当烧窑作业到临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色。若用捅开的窑顶自然冷却的办法降低温度,砖就变成了红色。
(1)从化学角度看,砖瓦呈红色的原因是_______________。
(2)现有一块红砖,实验台上有浓硫酸、3mol·L-1的盐酸、0.1mol·L-1硫氰化钾溶液、0.1mol·L-1的氯化铁溶液、0.01mol·L-1的氢氧化钠溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁(简述实验步骤、所用仪器、产生现象、所得结论、写出验证三价铁的离子方程式)。__________。
参考答案:(6分)⑴捅开窑顶,空气进入窑内,使铁元素氧化成红棕色的Fe2O3。(2分)
⑵先将红砖砸碎,取少量放入研钵中,研成粉末,取该粉末放入试管中,向其中加入3mol·L-1的盐酸,振荡、静置,然后滴加KSCN溶液,溶液变红,则证明有Fe3+存在。(2分)
Fe3+?+? 3SCN—?=Fe(SCN)3(2分)
本题解析:(1)如果捅开窑顶,空气进入窑内,使铁元素氧化成红棕色的Fe2O3,所以砖瓦呈红色。
(2)由于铁离子能和KSCN溶液发生反应使溶液呈红色,据此可以检验铁离子。但前提是把砖瓦中铁的氧化物溶解。由于浓硫酸具有强氧化性,所以不能选择浓硫酸,而是选择盐酸。因此正确的操作是先将红砖砸碎,取少量放入研钵中,研成粉末,取该粉末放入试管中,向其中加入3mol·L-1的盐酸,振荡、静置,然后滴加KSCN溶液,溶液变红,则证明有Fe3+存在。其中验证三价铁的离子方程式是Fe3+?+? 3SCN—?=Fe(SCN)3。
点评:该题主要通过铁离子的检验,考查学生实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力,以及语言文字的表达和组织能力。
本题难度:一般
3、选择题 在O2中灼烧0.44g硫和铁组成的化合物,使其中的硫全部变为SO2,把这些SO2全部转化为H2SO4,这些H2SO4可以用20mL0.5 mol/L的NaOH溶液完全中和,则原化合物的化学式为?
A.FeS
B.FeS
C.Fe2S3
D.Fe3S4
参考答案:B
本题解析:根据转化过程中,硫原子守恒:S~H2SO4~2NaOH可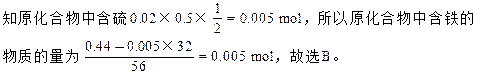
本题难度:一般
4、填空题 A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为?;分子的稳定性B ?M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是?。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是??mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,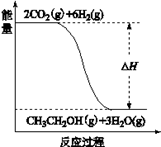
①反应是?反应(填“放热”或“吸热”),判断依据是?
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = ?KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是?(填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
参考答案:(1)NH3的电子式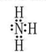 ,>
,>
(2)取反应后的溶液于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2;+或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;1
(3)①放热;反应物总能量高于生成物总能量?② 0.125a?③ BD
本题解析:(1) C在空气中易变成A,气态氧化物中有NO空气中变成NO2,则C为NO,A为NO2,B为水,D为硝酸。M为氨气,电子式为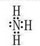 ,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
(2) B是黑色有磁性的氧化物,B为四氧化三铁,与盐酸反应生成的低价金属阳离子是Fe2+,检验Fe2+的方法是取反应后的溶液少量于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2+,或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;D为单质铁,与N中的Fe3+反应生成Fe2+,28gFe溶解时,转移电子0.5mol×2=1mol
(3)①由图可知,反应物的总能量高于生成物的总能量,所以该反应为放热反应;
②△H =" a" KJ/mol,即2mol的CO2完全反应的热效应,标况下5.6LCO2的物质的量为0.25mol,其热效应为0.25/2×a KJ/mol="0.125a" KJ/mol
③A、反应的任何状态都有生成1 mol CH3CH2OH的同时,生成3 mol H2O,错误;B、容器中各组份的物质的量浓度不随时间而变化,符合化学平衡的特征,正确;C、恒容容器中密度始终不变,错误;D、随反应的进行,气体分子数在减少,当达到平衡时,不再减少,保持不变,正确,答案选BD。
本题难度:一般
5、填空题 钢铁工业是国家工业的基础,请回答:钢铁冶炼、腐蚀与防护过程中的有关问题。
(1)工业用热还原法冶炼生铁的主要原料有?,设备的名称是??写出用还原剂CO还原赤铁矿(主要成分为Fe2O3)的化学方程式
?。
(2)写出钢铁在潮湿空气中发生锈蚀时的正极反应方程式??
生成铁锈(Fe2O3..XH2O)的化学方程式为?.
(3)生铁的用途远远不及钢材广泛,人们把较多的高炉生铁直接冶炼成钢,由生铁直接在纯氧顶吹转炉中转化成钢时,是把有害杂质除掉而保留有益元素,可以概括为??
??。为了防止钢铁制品发生锈蚀,可以在钢铁零件的表面进行电镀铜等措施,电镀铜时的阳极反应为??。
参考答案:(1)铁矿石、焦炭、石灰石?高炉?
Fe2O3+3CO="2" Fe+3CO2?
(2)O2+2H2O+4e-=4OH-? 4 Fe+3O2+2XH2O="2" Fe2O3.XH2O?
(3)降碳、除硫、磷,脱氧,调硅锰? Cu-2e-=Cu2+
本题解析:略
本题难度:一般