时间:2017-11-05 20:42:10
1、实验题 (16分)铁、铝、铜等金属及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是?;X与过量浓硝酸反应后溶液中含有的盐的化学式?,检验该盐溶液中含有的阳离子的试剂为________________
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是________
A.Mg2+? B.Fe2+?C.Al3+?D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: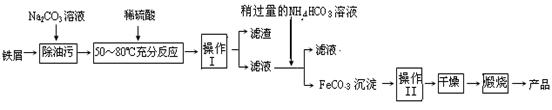
回答下列问题:
①操作Ⅰ的名称是?,操作Ⅱ的名称是?;
操作操作Ⅱ的方法为_____________________________________________________________
_______________________________________________________________________________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)?;
③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3-? FeCO3↓+ ??+ H2O
(4)有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===
5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除
天平、玻璃棒、烧杯、胶头滴管外,还需?。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是?。
a.稀硝酸? b.稀盐酸? c.稀硫酸? d.浓硝酸
③某同学设计的下列滴定方式,最合理的是?(夹持部分略去)(填字母序号)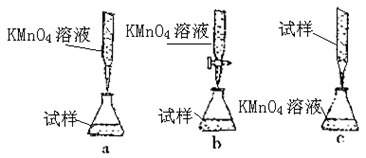
参考答案:(1)Fe2+? Fe3+? H+;Fe(NO3)3?KSCN溶液
(2)BC?;
(3)①过滤,洗涤;在漏斗中加入适量蒸馏水,没过沉淀, 让蒸馏水自然流下,重复数次.
② CO32- + H2O  ?HCO3- + OH-
?HCO3- + OH-
③? Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O;
(4)①250mL容量瓶?②c?③b
本题解析:(1)磁性的固体Y应该是四氧化三铁,所以与足量盐酸反应后,溶液中的阳离子分别是Fe2+、Fe3+、H+。
由于硝酸足量,故金属铁元素一定以Fe(NO3)3的形式存在
一般用KSCN溶液来检验Fe3+的存在
(2)氢氧化钠是过量的,因此得不到氢氧化铝沉淀。又因为氢氧化亚铁极易被氧化生成氢氧化铁,所以滤渣应该是氢氧化铁、氢氧化镁和氢氧化铜。滤渣灼烧后生成氧化铁、氧化镁和氧化铜,与足量盐酸反应生成氯化铁、氯化镁和氯化铜,因此所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,即答案选BC。
(3)①滤渣从溶液中分离出的方法是过滤,即操作I的名称是过滤。碳酸亚铁沉淀在烘干、煅烧之前必须进行洗涤,所以操作Ⅱ的名称是洗涤。
②Na2CO3溶液由于水解呈碱性:CO32- + H2O  ?HCO3- + OH-,在碱性条件下油脂可水解为可溶性物质
?HCO3- + OH-,在碱性条件下油脂可水解为可溶性物质
③滤液中FeSO4与加入的NH4HCO3反应生成了FeCO3沉淀,为保证电荷守恒及元素守恒,产物中必须还有CO2及水生成:Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
(4)①由于是配制250ml溶液,所以还需要250 mL容量瓶。
②由于高锰酸钾溶液具有强氧化性,盐酸在常温下即可被其氧化,故一般用稀硫酸酸化,所以答案选c(硝酸不论稀、浓均具有强氧化性,一般不作为酸化溶液)
③由于待测溶液水解呈酸性,不能用碱式滴定管盛放,排除c;高锰酸钾溶液具有强氧化性,不能用碱式滴定管盛放,排除a;故选项b符合题意
本题难度:简单
2、填空题 (11分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下: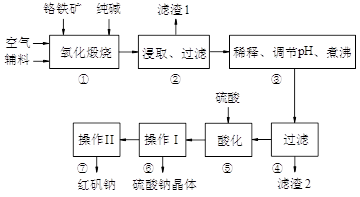
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2 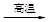 ?8Na2CrO4 + 2Fe2O3 + 8CO2
?8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应有多个如:Al2O3 + Na2CO3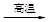 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。请再写一个①中的副反应方程式?
(2)“②”中滤渣1的成分是____ 和____,“③”中调pH值是_______ (填“调高”或“调低”),“④”中?滤渣2的成分是H2SiO3、Al(OH)3 。
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:__________________________。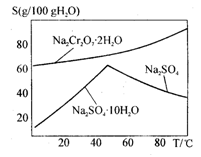
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II 是______(填序号)。
是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
参考答案: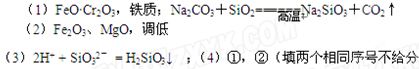
本题解析:略
本题难度:一般
3、实验题 (共6分,每空2分)铜是日常生活中常见的金属。已知铜的原子序数为29。回答问题: (1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式?。
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式?。 (2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
| ? |
 (3)写出你所设计装置中的化学反应的方程式?。
(3)写出你所设计装置中的化学反应的方程式?。参考答案:
 (1)Cu+H2O2+2H+ =Cu2+ +2H2O
(1)Cu+H2O2+2H+ =Cu2+ +2H2O (2)
(2)
通电
 (3)Cu+H2SO4 == CuSO4 +H2↑
(3)Cu+H2SO4 == CuSO4 +H2↑
本题解析:略
本题难度:简单
4、选择题 在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及其硫酸盐的信息,用以证明火星上存在或曾经存在过水,以下叙述正确的是
A.Fe2O3与Fe3O4互为同素异形体
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤 →向滤液中滴加KSCN溶液
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.明矾属硫酸盐,含结晶水,是混合物
参考答案:C
本题解析:
正确答案:C
A.不正确,Fe2O3与Fe3O4不互为同素异形体,它们不是单质。
B.不正确,步骤为:样品→粉碎→加稀盐酸溶解→过滤 →向滤液中滴加KSCN溶液
C.正确,除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.不正确,明矾属硫酸盐,含结晶水,但组成成分只有一种,不是混合物,是纯净物。
本题难度:一般
5、填空题 钢铁工业是国家工业的基础,请回答:钢铁冶炼、腐蚀与防护过程中的有关问题。
(1)工业用热还原法冶炼生铁的主要原料有?,设备的名称是??写出用还原剂CO还原赤铁矿(主要成分为Fe2O3)的化学方程式
?。
(2)写出钢铁在潮湿空气中发生锈蚀时的正极反应方程式??
生成铁锈(Fe2O3..XH2O)的化学方程式为?.
(3)生铁的用途远远不及钢材广泛,人们把较多的高炉生铁直接冶炼成钢,由生铁直接在纯氧顶吹转炉中转化成钢时,是把有害杂质除掉而保留有益元素,可以概括为??
??。为了防止钢铁制品发生锈蚀,可以在钢铁零件的表面进行电镀铜等措施,电镀铜时的阳极反应为??。
参考答案:(1)铁矿石、焦炭、石灰石?高炉?
Fe2O3+3CO="2" Fe+3CO2?
(2)O2+2H2O+4e-=4OH-? 4 Fe+3O2+2XH2O="2" Fe2O3.XH2O?
(3)降碳、除硫、磷,脱氧,调硅锰? Cu-2e-=Cu2+
本题解析:略
本题难度:一般