时间:2017-09-25 19:13:31
1、选择题 在20 mL1 mol/LNaHCO3溶液中,当HCO3-+H2O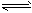 H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
[? ]
A.H2O(l)
B.Ba(OH)2(s)
C.NaHSO3(s)
D.NaOH(s)
参考答案:BD
本题解析:
本题难度:一般
2、选择题 下列过程或现象与盐类水解无关的是?(?)
A.纯碱溶液加热可增加去污效果
B.在潮湿的环境下铁片表面形成红棕色水膜
C.氯化铁饱和溶液滴入沸水中形成胶体
D.NaHCO3与Al2(SO4)3可作为泡沫灭火器的反应药剂
参考答案:B
本题解析:加热促进CO32-水解,A正确;潮湿环境下铁生锈,是因为发生了原电池反应,B错误;加热、增大氯化铁浓度促进氯化铁水解,C正确;Al3+与HCO3-发生双水解反应生成二氧化碳,D正确。
点评:铁表面形成铁锈的原理是潮湿环境中形成原电池,电池反应为2Fe+O2+2H2O=2Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3、Fe(OH)3失水形成Fe2O3·xH2O。
本题难度:一般
3、选择题 在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是(? )
A.AlCl3
B.Na2SO3
C.KMnO4
D.MgSO4
参考答案:D
本题解析:A项,AlCl3溶 液蒸干后,灼烧得到Al2O3;B项,Na2SO3溶液蒸干后,灼烧过程被氧化得Na2SO4。C项,KMnO4溶液蒸干后,得KMnO4,灼烧后得K2MnO4、MnO2。D项,MgSO4溶液蒸干后得MgSO4,灼烧后仍得MgSO4。
本题难度:一般
4、选择题
A.0.2 mol/L的NaHCO3溶液:
c(HCO3-)>c(CO32-)>0.1 mol/L>c(H2CO3)
B.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合:
c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L
D.0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合
c(CO32-)+2c(OH-)=?c(HCO3-)+3c(H2CO3)+2c(H+)
参考答案:CD
本题解析:该题要求要求学生根据溶液中盐的水解、弱电解质的电离、电荷守恒等化学变化的规律,判断溶液中离子浓度的相对大小,综合考查学生对电解质溶液基本原理的理解情况和综合分析解决问题的能力。
A中HCO3-、CO32-的浓度不可能都大于0.1 mol/L,否则加起来就大于0.2 mol/L;B中所得混合溶液应显酸性;C实际考查的是电荷守恒,c(Na+)=0.1 mol/L;D中可得电荷守恒等式c(Na+)+c(H+)=?c(HCO3-)+2 c(CO32-)+c(OH-)和物料守恒等式2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],两式消去c(Na+)即可判断。
本题难度:一般
5、选择题 25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH3·H2O四种溶液中,测得c(NH)分别为a、b、c、d(单位为mol/L),下列判断正确的是(?)
A.a=b=c=d
B.a>b>d>c
C.d >a>c>b
D.c>a>b>d
参考答案:D
本题解析:氨水是弱碱在溶液中部分电离,其余均为盐在溶液中全电离,所以氨水中铵根离子的浓度最小即d最小;根据铵根离子的水解平衡 ,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)大小顺序为c>a>b>d,所以答案选D。
,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)大小顺序为c>a>b>d,所以答案选D。
本题难度:简单