时间:2017-09-25 19:13:31
1、选择题 盐的水解程度大小可以用“水解度”来表示。关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2L1mol·L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是
A.0.01%
B.0.1%
C.0.2%
D.1%
参考答案:A
本题解析:pH=10,则溶液中OH-的浓度是0.0001mol/L,所以A-的水解程度是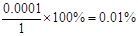 ,答案选B。
,答案选B。
点评:本题主要考查学生获取信息的能力,通过信息进行解题。
本题难度:一般
2、选择题 根据所学化学知识,判断施用钾肥草木灰(主要成份是K2CO3)时,不能和下列化肥混合使用的是(? )
A.NH4HCO3
B.KCl
C.CO(NH2)2
D.KNO3
参考答案:A
本题解析:碳酸钾溶于水发生水解反应,显碱性,而碳酸氢铵中的NH4+水解显酸性,二者会相互促进,造成肥料的损失,所以答案是A。
本题难度:一般
3、选择题 下列有关说法正确的是? (? )
A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0
B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应
C.为保护海轮的船壳,常在船壳上镶入锌块
D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动
参考答案:C
本题解析:A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,根据ΔG=ΔH-TΔS<0,说明该反应的ΔH<0;B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是吸热反应,不是放热反应; C.为保护海轮的船壳,常在船壳上镶入锌块,锌块与船壳构成原电池的两极,锌块为阳极,保护阴极船壳; D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+是阳离子,向阴极移动。
本题难度:简单
4、选择题 25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是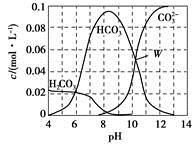
A.W点所示的溶液中:c(Na+)+c(H+)=2c(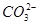 )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(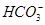 )+c(
)+c(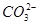 )<0.1 mol·L-1
)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(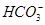 )=c(OH-)+c(Cl-)
)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(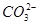 )>c(
)>c(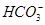 )>c(H2CO3)
)>c(H2CO3)
参考答案:B
本题解析:对A项,根据电荷守恒知,c(Na+)+c(H+)=2c(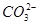 )+c(
)+c(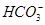 )+c(OH-)+c(Cl-),此时c(
)+c(OH-)+c(Cl-),此时c(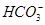 )=c(
)=c(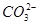 ),A错误;对B项,pH=4时,c(
),A错误;对B项,pH=4时,c(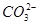 )=c(
)=c(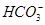 )≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c(
)≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c(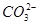 )+c(
)+c(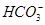 )+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c(
)+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c(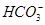 )+2c(
)+2c(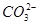 ),可推出c(H+)+2c(H2CO3)+c(
),可推出c(H+)+2c(H2CO3)+c(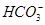 )=c(OH-)+c(Cl-),C错误;对D项,c(
)=c(OH-)+c(Cl-),C错误;对D项,c(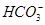 )最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时
)最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时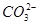 约为0.08 mol,故pH=11时,肯定是c(
约为0.08 mol,故pH=11时,肯定是c(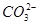 )>c(Cl-),D错误。
)>c(Cl-),D错误。
本题难度:一般
5、选择题 实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里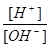 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
A.C(B+)>C(A-)>C(OH-)>C(H+)? B.C(A-)>C(B+)>C(H+)>C(OH-)
C.C(B+)=C(A-)>C(H+)=C(OH-)? D.C(B+)>C(A-)>C(H+)>C(OH-)
参考答案:C
本题解析:
分析:常温下0.1mol/L某一元酸(HA)溶液的pH等于l,说明HA完全电离,为强酸,0.1mol/L某一元碱(BOH)溶液里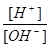 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
解答:解:常温下0.1mol/L某一元酸(HA)溶液的pH等于l,说明HA完全电离,为强酸,0.1mol/L某一元碱(BOH)溶液里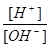 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,
C(B+)=C(A-)= 0.1mol/L
故C(B+)=C(A-)>C(H+)=C(OH-)?选C
点评:本题考查离子浓度的大小比较,题目难度中等,解答该题的关键是根据溶液的pH和溶液中氢离子与氢氧根离子判断电解质的强弱.
本题难度:一般