时间:2017-09-25 18:31:38
1、选择题 下列有关物质的性质或应用说法正确的是( )
A.糖类、油脂、蛋白质在一定条件下均可以水解
B.医疗上可用BaCO3作X射线透视肠胃的内服药剂
C.从海水中得到氯化镁晶体,电解氯化镁晶体可获得金属Mg
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
参考答案:A、糖类分单糖、二糖和多糖,单糖不水解,二糖、多糖、油脂、蛋白质在一定条件下均可以水解,故A错误.
B、碳酸钡是弱酸盐,能和盐酸反应,但硫酸钡既不和酸反应也不和碱反应,所以医疗上可用BaSO4作X射线透视肠胃的内服药剂,故B错误.
C、镁是活泼金属,所以镁的冶炼方法是电解氯化镁,但必须是电解熔融态的氯化镁不是氯化镁晶体,故C错误.
D、硫酸钙是微溶性的物质,能和碳酸钠反应生成难溶性的碳酸钙,碳酸钙和盐酸能反应,所以锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下列说法中合理的是
[? ]
A.在Na2S溶液中加入AgCl固体,溶液中c(S2-)会下降
B.常温下,AgCl在物质的量浓度相同的CaCl2溶液和NaCl溶液中的溶解度相同
C.向0.1 mol/L的ZnCl2溶液中通入足量的H2S气体,最终得不到沉淀是因为c(S2-)·c(Zn2+)<Ksp(ZnS)
D.25℃时,Ksp[Mg(OH)2]=5.61×10-12、Ksp(MgF2)=7. 42×10-11;则向Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:A
本题解析:
本题难度:一般
3、选择题 在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:



 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
A.Ag2O
B.Ag2CrO4
C.AgHCrO4
D.Ag2Cr2O7
参考答案:B
本题解析:略
本题难度:一般
4、选择题 已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是( )
A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力
D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀
参考答案:D
本题解析:A、Ksp不随浓度变化,只与温度有关,故A错误;B、NH4+结合OH-使氢氧化镁溶解平衡正向移动,Mg2+增大,故B错误;C、因氢氧化镁溶度积小,因此25℃时,Mg(OH)2的溶解能力小于MgF2的溶解能力,故C错误;D、二者Ksp接近,使用浓NaF溶液可以使氢氧化镁转化为MgF2,故D正确,故选D。
考点:考查难溶电解质的溶解平衡和沉淀转化
本题难度:困难
5、填空题 (13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
| | | | X |
| Y | | | Z |
 H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 |
| 平衡常数 | 9.94 | 9 |
 Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。参考答案:
I、(1)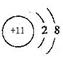 ;
;
(2)CH4
(3)SiO2+2OH-=SiO32-+H2O
(4)SiO2+C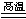 Si+CO↑
Si+CO↑
(5)KA+CO2+H2O=HA+KHCO3
II、(6)放热
(7)K=c(H2)c(CO2)/c(CO)c(H2O)
(8)40%;1
(9)C
本题解析:I、25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13,说明M是强碱,根据X、Y、Z在元素周期表中的位置判断Y是Na元素,对应的最高价氧化物的水化物是氢氧化钠,为强碱;则X是C元素,Z是Si元素。
(1)Na的离子结构示意图为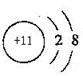 ;
;
(2)C的非金属性大于Si,所以C的气态氢化物CH4的稳定性较强;
(3)因为氢氧化钠与玻璃塞中的二氧化硅反应生成粘性较大的硅酸钠,所以不能用带磨口玻璃塞的试剂瓶盛装氢氧化钠溶液,离子方程式是SiO2+2OH-=SiO32-+H2O;
(4)工业上用单质碳还原二氧化硅制取Si单质,化学方程式是SiO2+C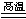 Si+CO↑;
Si+CO↑;
(5)根据所给酸的电离常数可知,酸性H2CO3>HA>HCO3-,所以二氧化碳与KA溶液反应只能生成碳酸氢钾和HA,则化学方程式是KA+CO2+H2O=HA+KHCO3。
II、(6)温度升高,平衡常数减小,说明升高温度,平衡逆向移动,则该反应是放热反应;
(7)根据平衡常数的定义,该反应的平衡常数K=c(H2)c(CO2)/c(CO)c(H2O);
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,则平衡时c(H2)=c(CO2)=2mol/L×60%=1.2mol/L,消耗水蒸气的浓度也是1.2mol/L,则水蒸气的转化率为1.2mol/L/3mol/L×100%=40%;平衡时水蒸气的浓度是3mol/L-1.2mol/L=1.8mol/L,CO的浓度是2mol/L-1.2mol/L=0.8mol/L,代入K=c(H2)c(CO2)/c(CO)c(H2O),则该温度下的平衡常数是1.22/(0.8×1.8)=1;
(9)A、Ni为固体,增加Ni的量,平衡不移动,CO的转化率不变,错误;B、缩小容器容积,压强增大,平衡右移,但ΔH不变,错误;C、反应达到平衡后,充入CO,相当于增大压强,平衡正向移动,则再次达到平衡时,CO的体积分数减小,正确;D、因为该反应有固体参加,气体的总质量分数变化,达到平衡时气体的质量不再变化,则气体的密度不变,所以当容器中混合气体密度不变时,可说明反应已达化学平衡状态,而4v正[Ni(CO)4]= v正(CO)表示正反应速率,不符合正逆反应速率相等的特征,不能判断平衡的到达,错误,答案选C。
考点:考查元素推断,化学用语的书写,化学平衡的移动机平衡常数的应用
本题难度:困难