时间:2017-09-25 16:35:25
1、选择题 若以w1和w2分别表示浓度为c1mol/L和c2mol/L硫酸的质量分数,已知2 w1=w2,则下列推断正确的是(硫酸的密度比纯水的大)
A.2c1=c2
B.2c2=c1
C.c2>2c1
D.c1<c2<2c1
参考答案:C
本题解析:设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
c1= 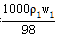 ,c2=
,c2= 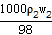 ,
,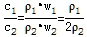 。因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1<ρ2,
。因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1<ρ2,
则c2>2c1。
故选C。
点评:本题考查物质的量浓度与质量分数的计算与比较,题目难度中等,注意浓硫酸的密度大于水,溶液的浓度越大,密度越大。
本题难度:简单
2、选择题 在25℃水中加入下列物质,不会使水的电离平衡发生移动的是:
A.KI
B.浓氨水
C.冰醋酸
D.热水
参考答案:A
本题解析:A.KI,是强酸强碱盐,没有弱离子,不水解,不会使水的电离平衡发生移动
B 浓氨水是弱碱,会抑制水的电离
C.冰醋酸是弱酸,会抑制水的电离
D 加热,会促进水的电离。
故选A。
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol?L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:C
本题解析:加热促进水的电离,但纯水仍然显中性,A不正确。醋酸是弱酸,稀释有利于电离,所以稀释至10倍后pH<4,B不正确。盐酸是强酸,所以0.2 mol?L-1的盐酸,与等体积水混合后浓度是0.1mol/L,所以pH是1,C正确。pH=3的醋酸溶液的浓度大于10-3mol/L,所以和氢氧化钠反应后,醋酸是过量的,因此溶液显酸性,D不正确。所以答案选C。
本题难度:一般
4、选择题 室温下0.1mol·L-1NaOH溶液滴定a mL某浓度的HCl溶液,达到终点时消耗b mLNaOH溶液,此时溶液中氢离子的浓度c(H+)/mol·L-1是(? )
A.0.1a/(a+b)
B.0.1b/(a+b)
C.1×107
D.1×10-7
参考答案:D
本题解析:强酸和强碱恰好反应是,溶液显中性。如果温度是常温,则氢离子浓度是1×10-7mol/L,答案选D。
本题难度:一般
5、选择题 用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为(?)
A.0.5 mol/L
B.2 mol/L
C.l mol/L
D.无法确定
参考答案:C
本题解析:
正确答案:C
该过程了生两个反应,先电解Cu (NO3)2溶液,后电解水
2H2O 2H2↑?+? O2↑
2H2↑?+? O2↑
0.5mol? 0.25mol
2Cu(NO3)2+2H2O 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
0.5mol? 0.5mol―0.25mol
C(Cu2+)=0.5mol/0.5?L=l mol/L
本题难度:简单