时间:2017-09-25 16:25:09
1、选择题 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )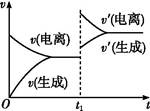
A.加少量烧碱溶液
B.升高温度
C.加少量冰醋酸
D.加水
2、选择题 有关下列两种溶液的说法中,①:0.1mo1?L-1?CH3COONa溶液?②:0.1mo1?L-1?CH3COOH溶液.正确的是( )
A.相同温度下,溶液中水的电离程度:溶液①<溶液②
B.等体积混合溶液①和溶液②,所得溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.加水稀释溶液①,溶液中
| c(CH3COOH)?c(OH-) c(CH3COO-) |
3、填空题 (14分)现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_____(填序号,下同),水的电离程度相同的是______。
(2)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。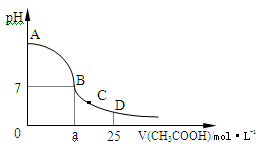
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
4、选择题 若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是
[? ]
A.生成了一种强碱弱酸盐
B.强酸溶液和弱碱溶液反应
C.弱酸溶液和强碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
5、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的HNO3跟pH=11的KOH
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的醋酸跟pH=11的Ba(OH)2
D.pH=3硫酸跟pH=11的NaOH