时间:2017-09-25 16:25:09
1、选择题 下列说法正确的是
[? ]
A.室温下,pH=8的碱性溶液中,可能存在CH3COOH分子
B.室温下,pH=6的酸性溶液中,不可能存在NH3·H2O分子
C.在0.1mol·L-1氢溴酸中加入适量的蒸馏水,溶液中c(OH-)减小
D.中性溶液中必然是c(H+)=c(OH-)=10-7mol·L-1
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是
A.根据Ksp(PbI2)>Ksp(AgCl)可以得出PbI2在水中的溶解能力比AgCl大
B.常温下,同浓度的Na2CO3与NaHCO3溶液相比,NaHCO3溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.常温下pH=7的氨水与硫酸铵的混合液中c(NH4+)与c(SO42-)之比小于2
参考答案:C
本题解析:A 错误,两种物质的类型不同
B 错误,碳酸根离子水解程度比碳酸氢根离子水解程度大,故同浓度的Na2CO3比NaHCO3溶液碱性强。
C 正确,NH4HSO4电离出氢离子,抑制了铵根离子水解,故NH4HSO4溶液铵根离子浓度大于等物质的量浓度的NH4Cl溶液。
D 错误,因为pH=7,c(NH4+)与c(SO42-)之比等于2。
本题难度:一般
3、选择题 有浓度为0.1 mol?L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol?L-1,b mol?L-1,c mol?L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为
n1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应开始时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________。
参考答案:(1)b>a>c;(2)n1=n2=n3;(3)V1=V3<V2;(4)v2>v1>v3
本题解析:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度其大小顺序为a=1/2b>c;(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1?=n2=n3;(3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3;(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3。
本题难度:一般
4、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:醋酸和硫酸溶液中的水电离出的氢离子和氢氧根离子的浓度相等,水电离出的氢离子就等于溶液中的氢氧根离子,pH均为3时溶液中氢离子的溶度为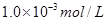 ,根据水的离子积可以得到
,根据水的离子积可以得到 ,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中
,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中 ,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
本题难度:简单
5、填空题 已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。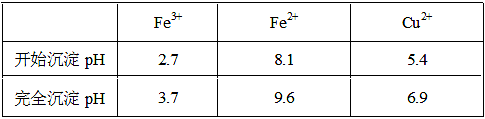
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为:?;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。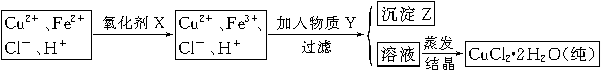
①加氧化剂X的目的是?,下列氧化剂中最适合作氧化剂X的是?(填序号);
A.NaClO
B.H2O2
C.KMnO4
D.HNO3
②物质Y的化学式是?;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是?;若25℃时,a=3的溶液中,c(Fe3+)=?mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
参考答案:(1)4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
(2)①将Fe2+氧化为Fe3+?B?②CuO[或Cu(OH)2或CuCO3] 3.7≤a<5.4? 4.0×10-5
(3)在HCl气氛下蒸发,以抑制CuCl2水解
本题解析:(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,目的是为了防止亚铁离子被氧化和析出沉淀,若只加盐酸、不加铁粉,溶液的亚铁离子被氧化为铁离子,其离子方程式为:4Fe2++O2+4H+ 4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
点评:本题考查了盐类水解,溶度积等知识点,这些考点都是高考考查的重点和难点,本题有一定的综合性,关键是要根据表中的数据进行解答,本题难度中等。
本题难度:一般