时间:2017-09-25 16:25:09
1、选择题 0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A.c(H+)>c(F-)
B.c(H+)>c(HF)
C.c(HF)>c(OH-)
D.c(HF)>c(F-)
参考答案:B
本题解析:由题知HF是弱酸,部分微弱电离,所以c(HF)大于c(H+),大于c(OH-),及c(F-),B错;由于水也电离,当然c(H+)大于c(F-),A正确;答案选B。
本题难度:一般
2、选择题 下列说法中正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.难溶于水的电解质不一定是弱电解质
C.氨气的水溶液可以导电,说明氨气是电解质
D.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
参考答案:B
本题解析:金属氧化物不一定是碱性氧化物,如过氧化钠,非金属氧化物不一定是酸性氧化物如一氧化碳,A错;电解质的强弱与物质的溶解性无关,电解质的强弱只看电解质在水中是否完全电离,若全电离则为强电解质,部分电离则为弱电解质,如碳酸钙虽然难溶于水但是溶于水的部分完全电离其属于强电解质,所以B正确;氨气水溶液能导电是因为氨气与水反应生成了一水合氨,一水合氨发生电离才可以导电,一水合氨属于电解质,但是氨气属于单质,既不是电解质也不是非电解质。C错;漂白粉用于自来水处理是因为漂白粉与空气中二氧化碳反应生成次氯酸,利用次氯酸的强氧化性达到杀菌消毒的目的,明矾是利用的铝离子的水解产生胶体,利用胶体的吸附性达到净化水的目的,二者原理不同,D错,所以选B。
本题难度:简单
3、填空题 (12分)Ⅰ.(1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以? ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为?。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是?。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因:?。
参考答案:Ⅰ.(1)酸,< ,Ag++H2O  ?AgOH+H+ ,抑制。(2)NaOH溶液
?AgOH+H+ ,抑制。(2)NaOH溶液
Ⅱ. (1)1∶10?(2)a+b=13或pH1+pH2=13
(3) 该碱为弱碱, 中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性。
本题解析:Ⅰ.(1)AgNO3是强酸弱碱盐,弱碱根离子水解消耗水电离产生的OH-,使盐的水溶液呈酸性。常温时的pH<7。水解的两种方程式是Ag++H2O  ?AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
?AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
本题难度:一般
4、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
| pH | c(CrO42—) | c(HCrO4—) | c(Cr2O72—) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
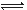 H++HCrO4—
H++HCrO4—参考答案:AC
本题解析:A由表中的数据在PH=4时,c(HCrO4—)= 0.1040可知:铬酸第一级电离方程式为H2CrO4 =H++HCrO4—。错误。B.由表中的数据可知:当PH=9时c(CrO42—)= 0.9960mol/L而c(HCrO4—)、c(Cr2O72—)很小很小。可?见要得到CrO42—应控制溶液的pH>9。正确。C.当电离达到平衡时, v(正)(HCrO4—)= 2v(逆)(Cr2O72—)。错误。D根据Cr守恒可确定c(H2CrO4)= c(CrO42—)+ c(HCrO4—)+2 c(Cr2O72—)= 0.9960+0.0031+0.0004×2=0.9999mol/L.因此该铬酸溶液的物质的量浓度约为1.00mol/L?。正确。2CrO4)溶液中,离子浓度与pH的关系的知识。
本题难度:一般
5、填空题 一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa pH 8.1 8.8 11.6 10.3 11.1 11.3 |
参考答案:(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC;
②据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强,没有HB-生成,说明得电子能力A-大于HB-,则得电子能力顺序为A->B2->HB-,故答案为:A->B2->HB-;
(2)各反应均有固体生成,其溶解度更小,故复分解反应能够向生成更难溶的物质的方向进行,
故答案为:由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行;
(3)溶液中的c(H+)=10-9mol.L-1,说明溶液呈碱性,只有Na2S和NaOH符合,故答案为:CD;
(4)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH?-)=1.0×10-3mol.L-l的氨水,一水合氨浓度远大于1.0×10-3mol.L-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c,
故答案为:b>a=d>c;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,两种溶液中c(Na+)相等,由于CH3COONa溶液中H+浓度大于NaCN溶液中H+的浓度,则CH3COONa溶液中阴离子浓度较大,
故答案为:③;>;
(6)向50mL?0.018mo1.L-l的AgNO3溶液中加入相同体积0.020mol.L-1的盐酸,盐酸过量,反应后的c(Cl-)=0.02mol/L×0.05L-0.018mol/L×0.05L0.1L=0.001mol/L,
则c(Ag+)=Ksp(AgCl)c(Cl-)=1.8×10-100.001mol/L=1.8×10-7?mol/L,
c(H+)=0.02mol/L×0.05L0.1L=0.01mol/L,
pH=2,
故答案为:1.8×10-7?mol/L;?2.
本题解析:
本题难度:简单