时间:2017-09-25 16:25:09
1、选择题 下列事实能说明醋酸是弱酸的是?
①下当温度低于16.6℃时醋酸可凝结成冰一样晶体?②0.1 mol/L的醋酸钠溶液的pH约为9?③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多?④0.1mol/L的醋酸的pH值约为4.8?⑤pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.②④⑤
B.②④
C.②③④
D.②③
参考答案:A
本题解析:醋酸钠溶液是盐溶液应该PH为7,实际上是9说明醋酸根发生了水解,醋酸是弱酸,②正确;0.1mol/L的醋酸的pH值应该为1,实际上是4.8,说明醋酸分子没有全部电离,醋酸是弱酸,④正确;如果醋酸是强酸则pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,消耗碱液的体积应该相同,实际上醋酸消耗的多说明醋酸是弱酸,溶液中存在没有电离的醋酸分子,所以耗碱增多,⑤正确;所以正确的是②④⑤答案选A。
本题难度:简单
2、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH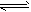 CH3COO-+H+,下列叙述正确的是
CH3COO-+H+,下列叙述正确的是
[? ]
A.加入水时,平衡向逆反应方向移动
B.加入少量CH3COONa固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大
D.加入少量NaOH固体,平衡向正反应方向移动
参考答案:CD
本题解析:
本题难度:一般
3、选择题 下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1 mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
参考答案:D
本题解析:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故A不选;B.常温下,测得0.1 mol/L醋酸溶液的pH=4,说明醋酸没有完全电离,可证明醋酸为弱酸,故B不选;C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C不选;D.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故选D.
考点:弱电解质
本题难度:一般
4、选择题 下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1mol·L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小
D.向0.1mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小
参考答案:C
本题解析:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,由于正反应是熵变增大的,则根据△G=△H—T·△S可知该反应的ΔH>0,A错误;B.金属性是Zn>Fe>Sn,则镀锌铁制品镀层破损后,铁制品熔融不会腐蚀,但镀锡铁则相反,因为此时铁是负极,失去电子,加快腐蚀,B错误;C.水解吸热,加热0.1mol·L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小,C正确;D.醋酸是弱电解质存在电离平衡,向0.1mol·L-1CH3COOH溶液中加水促进电离,氢离子浓度减小,但氢离子个数增加,所以c(H+)与c(CH3COOH)的比值增大,D错误,答案选C。
考点:考查反应自发性、金属腐蚀、水解以及电离平衡等
本题难度:一般
5、填空题 (12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-) ②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在 种粒子,且c(HX) c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-) 0.1 mol/L(忽略体积变化)。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
参考答案:(1) < ; (2) 6 ,< , = ; (3 ) 碱 , X-+H2O 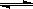 HX+OH-
HX+OH-
本题解析:略
本题难度:一般