时间:2017-09-25 16:18:50
1、选择题 在密闭容器中进行如下反应:X2(g)+Y2(g) 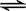 2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是
2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是
A.Z为0.3摩尔/升
B.Y2为0.4摩尔/升
C.X2为0.2mol/L
D.Z为0.4摩尔/升
参考答案:A
本题解析:由于是可逆反应,因此反应物和生成物的浓度不可能为0。如果起始时向正反应方向进行,最多可以生成0.2mol/L的Z,因此Z的浓度一定小于0.4mol/L。如果起始时向逆反应方向进行,则0.2mol/L的Z可以生成0.1mol/L的X和Y,则X和Y的浓度不可能大于0.2mol/L和0.4mol/L,所以选项B、C、D均是不可能的,答案选A。
本题难度:一般
2、选择题 在一定温度下,向a L密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g) + 2Y(g) 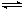 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.正反应和逆反应的速率都为零
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确,A不正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,C不能说明。D中反应速率的方向相同,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,因此答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
3、填空题 (6分)【Ⅰ】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 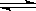 ?2C(g)+2D(g),
?2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为??;
(2)反应前A的物质的量浓度是?;
【Ⅱ】某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 ?2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
?2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
参考答案:【Ⅰ】(1? 4mol·L-1·s-1(2分)(2)1.5 mol·L-1(2分)【Ⅱ】33.3%(2分)
本题解析:【Ⅰ】3A(g) +B(g)  2C(g)+2D(g)
2C(g)+2D(g)
n始? xmol? xmol? 0? 0
n变 1.2mol? 0.4mol? 0.8mol? 0.8mol
n末1.8mol? 0.6mol? 0.8mol? 0.8mol
x----1.2mol==1.8mol? x===3.0mol? Vc==0.8mol/2L×10s=4mol·L-1·s-1
CA==3.0mol/2L=1.5 mol·L-1
【Ⅱ】2 SO2+ O2 ?2 SO3
?2 SO3
n始? 0.3mol? 0.2mol? 0
n变2xmol? xmol? 2xmol
n末o.3—2x? 0.2-x ?2x
n1=0.5mol? n2=o.5-x? n1/n2=p1/p2=10:9? x=0.05
αSO2=0.1mol/0.3mol=33.3%
本题难度:一般
4、选择题 在一个固定体积的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g) 2Z(g) +nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3, 则该反应方程式中的n值是
2Z(g) +nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3, 则该反应方程式中的n值是
[? ]
A.3
B.4
C.5
D.6
参考答案:D
本题解析:
本题难度:一般
5、选择题 某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( ? )
| ? | A | B | C |
| Ⅰ | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
| Ⅱ | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
| Ⅲ | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
| Ⅳ | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
参考答案:D
本题解析:A、把平衡时各物质的浓度代入平衡常数表达式进行计算得:KⅠ = 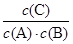 ?=
?= 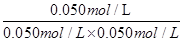 = 20mol-1·L,正确;B、计算平衡常数:KⅡ =
= 20mol-1·L,正确;B、计算平衡常数:KⅡ = 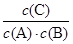 ?=
?= 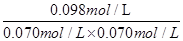 ?= 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ =
?= 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ = 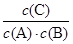 ?=
?= 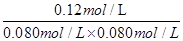 ?= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
?= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
本题难度:一般