时间:2017-09-24 00:20:57
1、实验题 (12分)实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀。
回答下列问题:?
(1)?本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有:
?。
(2)?实验中用托盘天平实际称取NaOH固体的质量是?。
(3)?上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容:
?。
(4)?在实验中,未进行操作④,所配溶液的浓度会?(填“偏高”、“偏低”或“无影响”,下同);
定容时俯视液面,所配溶液的浓度会?。?
称量时已观察到NaOH吸水,所配溶液的浓度会?。
参考答案:(共12分)
(1)玻璃棒?胶头滴管?(各1分)
(2)2.0g?(2分)
(3)②步后,溶液冷却后将其沿玻璃棒转移至容量瓶 中;(2分)
中;(2分)
(4)偏高?偏高?偏低?(各2分)
本题解析:略
本题难度:简单
2、实验题 已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下: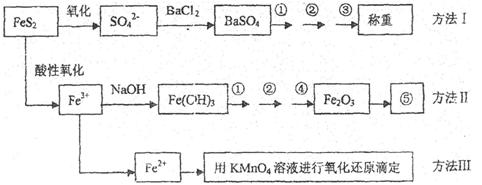
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈
B.定容时俯视
C.称量时物质和砝码位置反了(需要游码)
D.容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
参考答案:(15分)(1)过滤(1分)?洗涤(1分)?干燥(1分)?坩埚、酒精灯(1分)?天平(1分)
(2)取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全(2分)
(3)A、B、D? (3分)
(4)有三个可能的原因:
①Fe(OH)3沉淀表面积大,易吸附杂质? (1分)
②过滤洗涤时未充分将吸附的杂质洗去? (1分)
③Fe(OH)3灼烧不充分,未完全转化为Fe2O3 (1分)u
(5)75.0%(2分)。
本题解析:略
本题难度:简单
3、实验题 有一种工业废水,已知其中含有大量硫酸亚铁和少量银离子,某课外活动小组设计了一个既经济又合理的方法回收金属银和硫酸亚铁晶体。根据初中学过的知识,可推测他们实验的步骤是:在废水中加入____,充分反应后,被加入的试剂仍有剩余;取过滤后的滤渣加入足量___, 反应完全后,再经过滤,得到的滤渣是___。将两次过滤后的滤液合并,与过量铁片再充分反应后过滤,滤液经过____操作,可得到该溶质的晶体。
参考答案:足量的铁片 ;稀硫酸 ;银 蒸发、结晶
本题解析:
本题难度:一般
4、实验题 电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。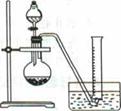
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、?、?、?。
(2)若实验前有1000mL、500 mL、250 mL的量筒备用,则应选用?mL的量筒。
(3)生成气体体积是???mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是??。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□?。若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液?mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为?。
参考答案:(1)圆底烧瓶;分液漏斗;量筒
(2)500
(3)336;使量筒内外液面相平、视线与量筒内液面的最低处相切
(4)2,1,3,1,2,2,4,H2O;300
(5)80%
本题解析:(1)从装置图中可以看出,玻璃仪器还有圆底烧瓶、分液漏斗和量筒。
(2)量筒中收集到气体360mL,因此应选择500mL的量筒。
(3)因为反应容器中的液体会使反应器中原有的空气进入量筒,因此收集到气体的体积为360mL-24mL=336mL。量筒读数时应注意使量筒内外液面相平,视线与量筒内液面的最低处相切。
(4)反应中,Mn的化合价由+7降至+2,降低5价,C的化合价由-1升至+4,升高5价,根据氧化还原反应得失电子守恒及原子守恒,可配平方程式。根据方程式可知:2KMnO4~C2H2,乙炔的物质的量为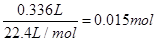 ,则需要高锰酸钾溶液的体积为
,则需要高锰酸钾溶液的体积为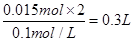 ,即300mL。
,即300mL。
(5)电石的纯度为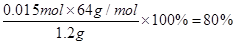 。
。
本题难度:一般
5、实验题 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是?。
(2)方案二:按下图装置进行实验。并回答以下问题。
①实验前先_______________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是?。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是??。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是?。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
参考答案:(1)保证NaHCO3全部分解?(2分)
(2)①检查装置的气密性(1分)?硫酸(1分)
防止空气中水蒸气、CO2进入C管被吸收(2分)?② C(2分)
③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(2分)
(3)①玻璃棒. 漏斗(2分)?
②在反应后小烧杯的上清液中,再滴加BaCl2溶液少许,如无白色沉淀生成说明沉淀完全(2分)
③ 56%(2分)
本题解析:略
本题难度:简单