时间:2017-09-24 00:20:57
1、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)完成以下实验设计表(表中不要留空格)。

[数据处理]实验测得p—CP的浓度随时间变化的关系如图,①②③分别代表以上三组实验测得的数据曲线。
(2)请根据实验①曲线,计算降解反应在 50~150s内的平均反应速率;v(p—CP)=?
_________?mol L-1
L-1 s-1。
s-1。
(3)实验①、②表明温度升高,该降解反应速率_____。?(增大或减小)但其他文献表明,温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:?_________________________________。
(4)实验③得出的结论是:pH等于10时,_________________________
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:_____________________________。
参考答案:(1)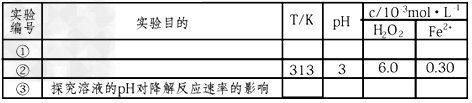 (2)8.0×10-6
(2)8.0×10-6
(3)增大;过氧化氢在温度过高时迅速分解。
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10
本题解析:
本题难度:一般
2、实验题 (16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是:?,读出甲管中液面的读数。
【方案II】
(1)称取碳酸钙样品M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外)?。
问题3:碳酸钙纯度计算公式?。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________?(偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是?(填选项编号)。
A.c、V
B.c′、 V′
C. M′
D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将?(偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将?。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是??。
参考答案:
问题1:向下移动乙管,使甲、乙两管中的液面持平?(2分)
问题2:托盘天平、酸式滴定管(或移液管)、碱式滴定管、锥形瓶、药匙(4分)
问题3: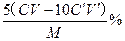 ?(3分)
?(3分)
问题4:无影响?(1分)
问题5:A、B?(2分)
问题6:偏小?偏大?(2分)
问题7:静置后,往上层清液中滴加Na2CO3溶液,若没有白色沉淀生成,则Na2CO3溶液过量?(2分)
本题解析:略
本题难度:简单
3、实验题 某化学学习小组利用如图所示装置来探究相应物质的化学性质。选择适当试剂完成实验A、B、C,并得出相应的实验结论。实验A、B、C所用试剂和所得结论列于表中。?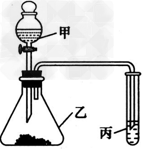
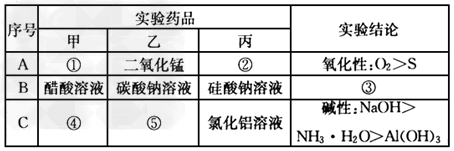
(1)乙装置的名称:_____________。 ?
(2)请填写①~⑤的试剂名称或实验结论:①___________;②__________;③________ ?;④___________;⑤______________。 ?
(3)小明利用该装置自行设计了一个实验——证明NO2具有氧化性(注:丙中已事先添加Na2S溶液)。据此回答下列问题: ?
①如何检验该装置的气密性:_______; ?
②打开甲装置的活塞后,装置乙中发生反应的化学方程式:___________; ?
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:__________ (用化学反应方程式和简要文字回答); ?
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:____________。
参考答案:(1)锥形瓶
(2)①双氧水(或过氧化氢溶液)?;②氢硫酸溶液?;③酸性:醋酸> 碳酸>硅酸 ;④浓氢氧化钠溶液(或饱和氢氧化钠溶液);⑤氯化铵固体(或NH4Cl晶体)
(3)①关闭分液漏斗的活塞,在丙中注入一定量的水,将导管插入水中,微热锥形瓶,一段时间后在导管口看到有气泡产生,撤去酒精灯,在导管中产生一段水柱,说明装置的气密性良好
②Cu+4HNO3(浓) =Cu(NO)2+2NO2↑+2H2O
③3NO2+H2O=2HNO3+ NO,NO2和水反应生成的HNO3是一种强氧化性的酸,也可将Na2S氧化使溶液变浑浊
④2NO+2OH-=NO3-+NO2-+ H2O
本题解析:
本题难度:一般
4、实验题 (14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。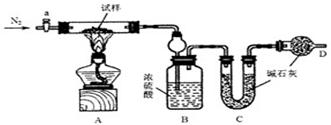

实验过程
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计 ):
):
(1)装置A中发生反应的化学方程式为?▲?。
(2)装置B的作用为?▲?。
装置C的作用为?▲?。
(3)实验过程中通入N2的目的为?▲?。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是(?▲?)(填选项字母)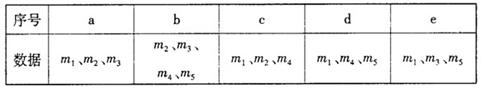
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3)?▲?(填“能”或“不能”)。若能,则w(NaHCO3)的计算式为:?▲?,若不能,此问不作答。
参考答案:
(1)2NaHCO3 Na2CO3 + CO2 + H2O (2分)、NH4HCO3
Na2CO3 + CO2 + H2O (2分)、NH4HCO3 NH3+ CO2+H2O (2分)
NH3+ CO2+H2O (2分)
(2)吸收反应生成的水蒸气和氨气(1分) ;吸收反应生成的CO2 (1分);
(3)把装置中的CO2、NH3和水蒸气排出,使其被装置B和装置C完全吸收(2分)
(4)b、c 、e? (3分,每项1分,选错一项倒扣一分,本题最低分0分)?;
(5)能(1分); ×100% 或 等价表达式 (2分)
×100% 或 等价表达式 (2分)
本题解析:略
本题难度:一般
5、实验题 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。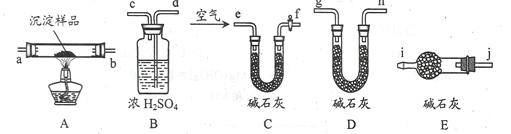
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按? f→a→b→___→___→___→___→j→i顺序连接。? | ? | ? |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
参考答案:(16分)
假设3:CuCO3和Cu(OH)2的混合物(2分)
(1)Cu2+?+ CO32-=CuCO3↓ (2分)
(2)发生水解反应(1分),且Cu(OH)2比CuCO3更难溶(1分)
(3)
实验步骤
预期现象
结论
①称量B、D的质量分别为ml、m2,将装置按? f→a→b→d→c→g→h或d→c→h→g(2分)→j→i顺序连接。?
?
?
②称取一定质量的沉淀于A中充分加热,然后从e口通入足量空气(2分),冷却后再称量B、D的质量分别为m3、m4
(1)若m1 = m3,m2 < m4
(2)若m1_<__m3,m2_=__m4
(3)若ml_<__m3,m2_<__m4(4分)
(1)假设1成立
(2)假设2成立
(3)假设3成立
?
(4)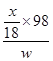 ×100%(或
×100%(或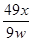 ×100%、49x/9w、4900x/9w%)(2分)
×100%、49x/9w、4900x/9w%)(2分)
本题解析:假设1说明碳酸铜是蓝色沉淀,假设2说明氢氧化铜是蓝色沉淀,则蓝色沉淀也可能是碳酸铜和氢氧化铜的混合物,由此确定假设3的内容;(1)若假设1成立,说明碳酸钠与硫酸铜直接发生复分解反应,生成碳酸铜沉淀和硫酸钠,即该反应实质为Cu2++CO32-=CuCO3↓;(2)若假设2成立,可能的原因是铜离子发生水解反应,且氢氧化铜比碳酸铜更难溶;(3)①读图,装置C的作用除去空气中的二氧化碳和水蒸气,防止干扰,所以该装置应放在最左边;A的作用是使蓝色固体受热分解,通过检验其分解产物是否有水蒸气、二氧化碳判断蓝色沉淀的组成;由于碱石灰既能吸收水又能吸收二氧化碳,浓硫酸只能吸收水,因此必须先通过盛有浓硫酸的洗气瓶,后通过盛有碱石灰的干燥器或U形管;为了防止右边装置外空气中的水蒸气和二氧化碳对实验造成干扰,还需要一个盛有碱石灰的U形管或干燥管;由于洗气时气体必须长进短出,U形管左进右出或右进左出都可以,则称量B、D的质量分别为m1、m2,将装置按f→a→b→d→c→g→h→j→i或f→a→b→d→c→h→g→j→i;称取一定质量的沉淀于A中充分加热,然后从e口通入足量空气,冷却后再称量B、D的质量分别为m3、m4,若m1= m3,m2< m4,说明沉淀分解产物没有水蒸气、只有二氧化碳,则假设1成立;若m1< m3,m2= m4,说明沉淀分解产物只有水蒸气、没有二氧化碳,则假设2成立;若m1<m3,m2< m4,说明沉淀分解产物既有水蒸气、又有二氧化碳,则假设3成立;(4)装置B增加的质量就是分解产物水的质量,由于n=m/M,则水的物质的量为x/18mol;由于Cu(OH)2 CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为
CuO+H2O↑中各物质的系数之比等于物质的量之比,则参加反应的氢氧化铜的物质的量为x/18mol;由于Cu(OH)2的式量为98,m=n?M,则参加反应的氢氧化铜的质量为98x/18g;由于沉淀样品质量为wg,则沉淀中氢氧化铜的质量分数为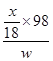 ×100%=
×100%=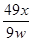 ×100%。
×100%。
本题难度:一般