时间:2017-08-26 03:25:01
1、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是
[? ]
A.两种溶液中,由水电离出的氨离子浓度均为1×10-11mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.分别加水稀释100倍后,醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:
本题难度:一般
2、选择题 根据下表提供的数据,下列判断正确的是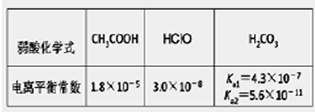
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: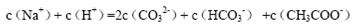
B.常温下,已知酸H2A存在如下平衡: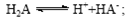 ;
;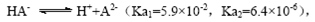 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
参考答案:D
本题解析:A、根据电荷守恒规律,等物质的量的Na2CO3和CH3COOH两种溶液混合一定有c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)+ c(HCO3-)+2 c(CO32-),错误;B、H2A为二元弱酸,则NaHA溶液的酸碱性未知,HA-的水解与电离程度的强弱无法判断,所以NaHA溶液中水的电离程度与纯水中水的电离程度无法比较,错误;C、 根据电离平衡常数可知,醋酸的酸性大于次氯酸,所以同浓度的醋酸钠与次氯酸钠的混合液中次氯酸根离子的水解程度大于醋酸根离子的水解程度,溶液呈碱性,则溶液中离子的浓度关系是c(Na+)> c(CH3COO-)> c(ClO-)> c(OH-)>c(H+),错误;D、常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当 c(CH3COOH):c(CH3COO-)=5:9时,根据醋酸的电离常数K=1.8×10-5= c(CH3COO-)c(H+)/ c(CH3COOH),则c(H+)=1×10-5mol/L,所以溶液的pH=5,正确,答案选D。
考点:考查电解质溶液中离子浓度的关系比较,电离常数的应用
本题难度:一般
3、填空题 已经知25℃时几种物质的电离度(溶液浓度为0.1mol)如下表: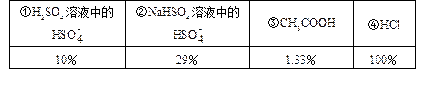
(已知(H2SO4的第一步是完全电离的)
(1)25℃时,0.1mol/L上述几种溶液[H+]由大到小的顺序是(填序号)____;
(2)25℃时,pH值相同的上述几种溶液,其物质的量浓度由大到小的顺序是____;
(3)25℃时,将足量的 Zn粉放入等体积、pH=1的上述几种溶液中产生氢气的体积(同温同压下),由大到小顺序为____;

参考答案:(1)①④②③
(2)③②④①
(3)③②①④
(4)HSO4-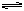 H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
本题解析:(1)对上述四种溶液,均为0.1mol/L时,H2SO4=H++HSO4-,HSO4-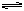 H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
∴顺序为①④②③
(2)25℃,pH值相同的四种溶液,[H+]浓度相同,其电离度越小,该电解质溶液的浓度越大,所以应为:③②④①,其中H2SO4的浓度最小,是因为它的第一步完全电离与HCl相同,但其第二步又可电离出一定的H+,所以二者综合,其浓度最小。
(3)在等体积,[H+]浓度相同的情况下,加入足量的Zn粉,将产生氢气的量与各电解质的浓度有关,因该反应可进行到底,溶液浓度越大,则溶质的物质的量越大,产生H2越多,但对H2SO4和HCl而言,其pH都为1,盐酸浓度要比H2SO4大;但反应中,盐酸完全消耗,而H2SO4为二元酸,第一步完全电离,第二步也在与Zn反应中趋于完全进行,所以[H+]浓度在反应中增加,产生的氢气量比盐酸多,顺序为③②①④。
本题难度:一般
4、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (10分)
Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2+ + 2OH-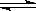 ?M(OH)2
?M(OH)2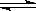 ?2H+ + MO22-
?2H+ + MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25Co时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)?,C(H+)?,水的电离度?,Kw?
(2)(4分)25Co时,向A的稀溶液中加入少量的烧碱固体。
则水的电离度?,溶液的pH?
Ⅱ、.(2分)室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为??10 (填大于、等于或小于)
参考答案:(10分)
Ⅰ、(1)
①C(OH-)变大?,C(H+)变大变,水的电离度变小?,Kw?不变?
(2)
则水的电离度?不变?,溶液的pH不变?
Ⅱ、.(2分)C(OH-)之比为?等于??10 (填大于、等于或小于)
本题解析:略
本题难度:一般