时间:2017-08-26 03:25:01
1、选择题 下列溶液中加入少量NaOH固体导电能力变化不大的是( )
A.NH3?H2O
B.CH3COOH
C.盐酸
D.H2O
参考答案:C
本题解析:
本题难度:一般
2、选择题 25℃时,pH=3的盐酸aL分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3mol·L-1的氨水bL,②c(OH-)=10-3mol·L-1的氨水cL,③c(OH-)=10-3mol·L-1的Ba(OH)2溶液dL。试判断a、b、c、d的数量大小关系为:
A.a=b>c>d
B.b>a=d>c
C.b>a>d>c
D.c>a=d>b
参考答案:B
本题解析:pH=3的盐酸和c(OH-)=10-3mol·L-1的Ba(OH)2溶液等体积混合,溶液呈中性,故a=d;pH=3的盐酸和c(NH3·H2O)=10-3mol·L-1的氨水等体积混合时恰好完全反应,溶液呈酸性,要使溶液呈中性,氨水的体积要大于盐酸,故b>a;pH=3的盐酸和c(OH-)=10-3mol·L-1的氨水等体积混合时氨水有剩余,PH>7,要使溶液呈中性,氨水的体积要小于盐酸,故a>c;所以b>a=d>c, B项正确。
考点:本题考查弱电解质电离和盐的水解。
本题难度:一般
3、选择题 在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是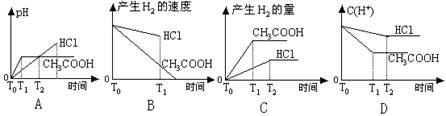
参考答案:C
本题解析:很多学生错选了A选项或D选项 PH=2的盐酸,其浓度为0.01 mol/L,则PH=2的醋酸,由于电离度只有1%,则醋酸浓度1mol/L
A错误的原因为:起始时PH不等于2
B中图像盐酸和醋酸标位颠倒了
D中盐酸是强酸,C(H+)的浓度下降速率快,斜率大,最终达到平衡,
正确图像如下: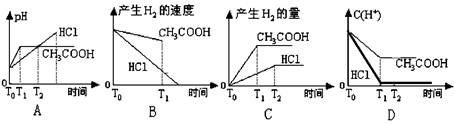
本题难度:一般
4、选择题 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
[? ]
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
参考答案:AC
本题解析:
本题难度:一般
5、选择题 在同体积0.3mol?L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是( )
A.硫酸中放出氢气量最多?
B.醋酸中放出氢气量最多?
C.盐酸中放出的氢气量最多?
D.硝酸中放出的氢气量最多
参考答案:稀盐酸、稀硫酸和醋酸与锌反应都生成氢气,稀硝酸和锌反应生成氮的化合物,硫酸是二元酸,醋酸和盐酸是一元酸,等浓度、等体积的醋酸和盐酸,与足量锌反应生成氢气的量相同;等浓度等体积的硫酸和盐酸中,硫酸中氢离子的物质的量大于盐酸,所以硫酸中产生氢气的量最多,
故选A.
本题解析:
本题难度:简单