时间:2017-08-26 01:23:15
1、实验题 传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1)用____(填仪器名称)量取10.00mL食用白醋,在________(填仪器名称)中用水稀释后转移到100mL
_______(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如左图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(如右图)。 
①用滴定管盛氨水前,滴定管要用________润洗2~3次,否则会使测定的醋酸的物质的量浓度_________(填“偏高”或“偏低”)。
②氨水与醋酸反应的离子方程式是_______________。
③食用白醋中醋酸的物质的量浓度是_________________。
2、选择题 中和滴定中,眼睛应注视的是( )
A.滴定管内的液面变化
B.液滴滴出的速度
C.滴定管刻度
D.锥形瓶中溶液颜色变化
3、实验题 用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下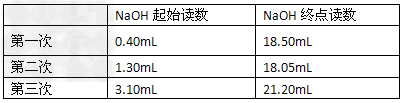
(1)达到滴定终点的时溶液颜色的变化为______色到_______色;? ?
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________;?
(3)以下操作造成测定结果偏高的原因可能是_____________。?
A、?滴定终点读数时,俯视滴定管的刻度,其它操作均正确 ?
B、?盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、?滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、?未用标准液润洗碱式滴定管
4、选择题 实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂(标准盐酸放在酸式滴定管中,NaOH 放在锥形瓶中)。下列操作中可能使测定结果偏低的是
[? ? ]
A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色的变化由黄色变为橙色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
5、简答题 化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L?H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL 滴定前刻度 滴定后刻度 1 20.00 1.50 23.70 2 20.00 1.02 21.03 3 20.00 2.00 21.99 | |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s 1 25 5.0 2.0 40 2 25 5.0(另外加少量MnSO4粉末) 2.0 4 3 60 5.0 2.0 25 |