时间:2017-08-26 01:23:15
1、填空题 现有常温条件下的甲、乙、丙三种溶液。甲为0.1mol·L-1的NaOH溶液,乙为 0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题
(1)乙溶液中,由水电离出的c(H+)=____________ mol·L-1;
(2)丙溶液中存在的电离平衡为________________________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为____________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题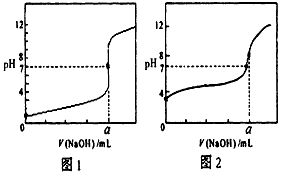
①甲溶液滴定丙溶液的曲线是_____________(填“图1”或“图2”);
②a=____________mL。
参考答案:(1)10-13?
(2)CH3COOH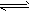 CH3COO-+H+, H2O
CH3COO-+H+, H2O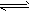 OH-+H+
OH-+H+
(3)丙>甲=乙
(4)①图2;②20.00
本题解析:
本题难度:困难
2、填空题 用某浓度NaOH溶液,分别中和同浓度、同体积的HCl、CH3COOH溶液。中和CH3COOH所用的指示剂可 选___________。若中和过程滴加NaOH溶液的速度相同,问中和HCl,还是中和CH3COOH过程中溶液的
pH改变更快?请简述原因__________________
参考答案:酚酞;中和HCl,溶液pH改变更快,原因:强碱滴定弱酸,形成缓冲溶液(如NaAc-HAc),造成pH变化变慢。
本题解析:
本题难度:一般
3、简答题 人体血液里Ca2+离子的浓度一般采用mg/mL来表示.加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出.试回答:
(1)现需要80mL0.02mol/L标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯,玻璃棒和______;配制时,KMnO4溶液应用强酸酸化,本实验选择______作酸化剂.若选择HNO3酸化,则结果可能______(偏大,偏小,不变)
(2)草酸跟KMnO4反应的离子方程式为:______.
(3)滴定时,根据现象______,即可确定反应达到终点.
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL 1 20.00 11.95 2 20.00 13.00 3 20.00 12.05 |
参考答案:(1)为了配制标准KMnO4溶液,应需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,所给仪器中缺少100mL容量瓶,
故答案为:100mL容量瓶、胶头滴管;
由于利用高锰酸钾溶液进行滴定来测量H2C2O4的含量,加入的酸不能具有氧化性,若用硝酸,硝酸能氧化H2C2O4,则消耗高锰酸钾溶液的体积偏小,测定结果偏小;盐酸中的氯离子具有还原性,能够被高锰酸钾氧化,对测定结果产生影响,所以不可以用盐酸;故实验中所用的KMnO4溶液要进行酸化,用于酸化的酸是稀H2SO4;
故答案为:稀H2SO4;偏小;
(2)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2+2Mn2++8H2O;
(3)反应结束前溶液是无色的,反应结束时再滴入高锰酸钾溶液,溶液由无色变为浅紫色,所以滴定终点现象是:滴入最后一滴高锰酸钾溶液后,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:溶液由无色变为浅紫色,且半分钟内不褪色;
(4)KMnO4溶液的体积第2组无效,求出1、3组的平均值为12.00mL,血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,由关系式:5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,可知:n(Ca2+)=n(H2C2O4)=52n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:0.024g20cm3=1.2 mg/cm3,
故答案为:1.2;
(5)当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应;
故答案为:小;
本题解析:
本题难度:简单
4、简答题 KMnO4溶液常用作氧化还原反应滴定的标准液其还原产物为Mn2+,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1h;
②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
③过滤得到KMnO4溶液并贮存;
④利用氧化还原滴定方法,在70~80℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度.请回答下列问题:
(1)配制好的KMnO4溶液储存方法是______.准确量取一定体积的KMnO4溶液需要使用的仪器是______.
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用______(填序号).
A.H2C2O4?2H2OB.FeSO4C.浓盐酸D.Na2SO3
(3)若准确称取Wg你选的基准试剂溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.KMnO4溶液的物质的量浓度为______mol?L-1.滴定终点颜色变化为______.
(4)若用放置两周的KMnO4标准溶液去测定水样中Fe2+的含量,测得的浓度值将______(填“偏高”、“偏低”或“无影响”).原因是______.KMnO4与Fe2+反应的离子方程式为______.
参考答案:(1)KMnO4为见光易分解,所以应密闭保存于以棕色细口瓶中,避免光照及高温;高锰酸钾溶液具有强氧化性,量取时应该选用酸式滴定管,
故答案为:存放在棕色的带玻璃塞的细口瓶中;
(2)A.H2C2O4?2H2O常温下是稳定的结晶水水化物,溶于水后纯度高、稳定性好,可以用作基准试剂,故A正确;
B.FeSO4?7H2O在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.浓盐酸不稳定,易挥发,不宜用作基准试剂,故C错误;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故选A;
(3)草酸的物质的量浓度为:Wg126g/mol0.5L=W63mol/L,
根据反应方程式6H++2MnO4-+5H2C2O4?2H2O═2Mn2++10CO2↑+18H2O中草酸和高锰酸钾之间的关系式得,酸性高锰酸钾的物质的量浓度=W63mol/L×0.025L×25V×10-3L=10W63Vmol/L;滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点,
故答案为:10W63V;滴下最后一滴KMnO4溶液后,溶液变成紫红色且半分钟内不褪色;
(4)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,反应的离子方程式为:8H++MnO4-+5Fe2+═Mn2++5Fe3++4H2O,
故答案为:偏高;高锰酸钾溶液浓度减小,滴定过程中消耗的高锰酸钾溶液体积偏大,测定亚铁离子含量偏高;8H++MnO4-+5Fe2+═Mn2++5Fe3++4H2O.
本题解析:
本题难度:一般
5、实验题 实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:
KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:
①向溶液中加入1~2滴指示剂;
②向锥形瓶中加20mL~30mL蒸馏水溶解;
③用NaOH溶液滴定到终点,半分钟不褪色;
④重复以上操作;
⑤准确称量0.4000g~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中;
⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响? ______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
参考答案:(1)酚酞;无色;红色
(2)⑤②①③④⑥
(3)无影响
(4)偏小
(5)0.1250mol/L
本题解析:
本题难度:困难