时间:2017-08-26 01:23:15
1、填空题 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:(1)以上步骤有错误的是(填编号)______,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)______;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)______;
(3)判断滴定终点的现象是:锥形瓶中溶液从______色变为______色,且半分钟不变色;
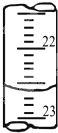
(4)右图是某次滴定时的滴定管中的液面,其读数为______mL;
(5)根据下列数据:请计算待测盐酸溶液的浓度:______?mol/L.
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) 滴定前读数 滴定后读数 第一次 20.00 0.40 20.40 第二次 20.00 4.00 24.00 第三次 20.00 2.00 24.10 | |
2、选择题 如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1mol?L
B.P点时反应恰好完全,溶液早中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
3、选择题 下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
4、选择题 已知常温、常压下,饱和CO2溶液的pH为3.9,则可推断用已知浓度的盐酸滴定未知浓度的NaHCO3溶液时,应选用的指示剂及滴定终点的颜色变化是( )
A.石蕊、由蓝变红
B.酚酞、红色褪去
C.甲基橙,由橙变黄
D.甲基橙、由黄变橙
5、实验题 下图是用0.1000?mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答: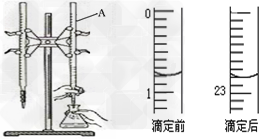
⑴?仪器A的名称是_________;
⑵?盐酸的体积读数:滴定前读数为_______?mL,滴定后读数为________mL;
⑶?某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是_____________(保留四位有效数字)? 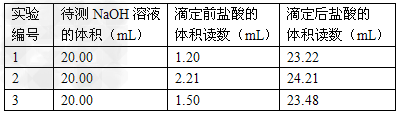
⑷判断到达滴定终点的实验现象是_____________________。
⑸对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果未用标准溶液润洗酸式滴定管,对测定结果的影响是______________;
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。