时间:2017-08-26 00:22:03
1、选择题 下列电离方程式正确的是(?)
A.H3PO4 3H++
3H++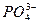
B.CaCO3 Ca2++
Ca2++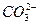
C.NaHS Na++H++S2-
Na++H++S2-
D.2H2O H3O++OH-
H3O++OH-
参考答案:D
本题解析:A选项中H3PO4为多元弱酸,电离方程式应分步书写;B选项CaCO3是盐,作为强电解质应完全电离;C选项中HS-不能拆,应书写为NaHS====Na++HS-;D选项为H2O的电离方程式,也可写为H2O H++OH-。
H++OH-。
本题难度:简单
2、填空题 (6分)根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH
参考答案:
本题解析:
本题难度:一般
3、填空题 某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-?H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
参考答案:(1)碱性 B2-+H2O  ?HB-+OH- (2)CD
?HB-+OH- (2)CD
(3)< 0.1 mol·L-1NaHB溶液的pH=2,说明其中c(H+)=0.01 mol·L-1,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol·L-1 H2B溶液中c(H+)<0.11 mol·L-1
(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
本题解析:(1)由H2B=H++HB-(完全电离),HB-?H++B2-(部分电离),知Na2B溶液中B2-将发生水解反应,故Na2B溶液显碱性,原因是B2-+H2O?HB-+OH-。
(2)在Na2B溶液中存在:Na2B=2Na++B2-,B2-+H2O  ?HB-+OH-,H2O
?HB-+OH-,H2O  ?H++OH-。由电荷守恒知c(Na+)+c(H+)=2c(B2-)+c(OH-)+c(HB-),C对。由物料守恒知c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对。在Na2B溶液中不存在H2B,A错,由物料守恒和电荷守恒知B错。(3)在NaHB溶液中,NaHB=Na++HB-,HB-
?H++OH-。由电荷守恒知c(Na+)+c(H+)=2c(B2-)+c(OH-)+c(HB-),C对。由物料守恒知c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对。在Na2B溶液中不存在H2B,A错,由物料守恒和电荷守恒知B错。(3)在NaHB溶液中,NaHB=Na++HB-,HB-  ?H++B2-,H2O
?H++B2-,H2O  ?
?
H++OH-。已知0.1 mol·L-1 NaHB溶液的pH=2,说明其中c(H+)=0.01 mol·
L-1,主要是HB-电离产生的。在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol·L-1H2B溶液中c(H+)<0.11 mol·L-1。(4)在NaHB溶液中各离子浓度大小顺序为c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)。
本题难度:一般
4、选择题 将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中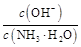 增大
增大
参考答案:D
本题解析:氨水中存在电离平衡:NH3·H2O N
N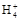 +OH-,加水稀释平衡右移,c(OH-)减小,由于温度不变,水的离子积不变,故c(H+)增大,故A、B、C都错。Kb=
+OH-,加水稀释平衡右移,c(OH-)减小,由于温度不变,水的离子积不变,故c(H+)增大,故A、B、C都错。Kb=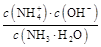 =
=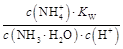 ,c(NH3·H2O)·c(H+)=
,c(NH3·H2O)·c(H+)=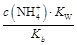 ,又稀释过程中c(N
,又稀释过程中c(N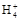 )减小,KW、Kb都不变,所以c(NH3·H2O)·c(H+)减小,又
)减小,KW、Kb都不变,所以c(NH3·H2O)·c(H+)减小,又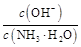 =
=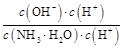 =
=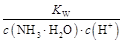 ,c(NH3·H2O)·c(H+)减小,所以
,c(NH3·H2O)·c(H+)减小,所以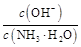 增大,所以D对。
增大,所以D对。
本题难度:简单
5、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是(?)
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.加入CaCl2溶液后体系中的c(H+)浓度不变
参考答案:C
本题解析:A、电离常数Ka(HF)=3.6×10-4,HF为弱电解质,不能完全电离,25℃时,0.1mol?L-1HF溶液中c(H+)=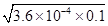 mol/L=6×10-3mol/L,pH>1,故A错误;B、溶度积只受温度的影响,不随浓度的变化而变化,故B错误;C、向1L?0.2mol?L-1HF溶液中加入1L?0.2mol?L-1CaCl2溶液,混合后,c(H+)=c(F-)=
mol/L=6×10-3mol/L,pH>1,故A错误;B、溶度积只受温度的影响,不随浓度的变化而变化,故B错误;C、向1L?0.2mol?L-1HF溶液中加入1L?0.2mol?L-1CaCl2溶液,混合后,c(H+)=c(F-)=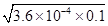 mol/L=6×10-3mol/L,c(Ca2+)=0.1mol/L,c2(F-)×c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系中有CaF2沉淀产生,故C正确;D、溶液中存在HF
mol/L=6×10-3mol/L,c(Ca2+)=0.1mol/L,c2(F-)×c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系中有CaF2沉淀产生,故C正确;D、溶液中存在HF H++F-,CaF2(s)
H++F-,CaF2(s) Ca2+(aq)+2F-(aq),加入CaCl2溶液后,Ca2+浓度增大,平衡向生成沉淀的方向移动,则F-浓度减小,促进HF的电离,c(H+)浓度增大,故D错误,答案选C。
Ca2+(aq)+2F-(aq),加入CaCl2溶液后,Ca2+浓度增大,平衡向生成沉淀的方向移动,则F-浓度减小,促进HF的电离,c(H+)浓度增大,故D错误,答案选C。
本题难度:一般