时间:2017-08-26 00:22:03
1、选择题 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是
A某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B 0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,AB难溶性离子化合物的Ksp=1.0×10-10, 其饱和溶液中pC(A+) +pC((B-)=10
参考答案:D
本题解析:pC(H+) +pC(OH-)=14,只是常温下成立,A错;CaCl2溶液中逐渐滴加纯碱溶液,C(Ca2+)减小,pC增大,B错;某浓度的NaOH溶液中滴加盐酸,OH?的物质的量浓度减少,而H+的物质的量浓度增大,即pC(H+)减少,C错。
本题难度:一般
2、选择题 下列物质属于电解质的是
A.Cu
B.N2
C.KNO3
D.C2H5OH
参考答案:C
本题解析:电解质研究的对象是化合物,是在水溶液或熔融状态能导电的化合物。AB为单质,D的水溶液不导电。KNO3是强电解质。
本题难度:简单
3、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.HCN易溶于水
B.HCN溶液能导电
C.1mol/L氢氰酸溶液的pH约为3
D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
参考答案:C
本题解析:能溶于水的物质不一定是弱电解质如硝酸故A选项是错误的。能导电不能说明氢氰酸是弱电解质。弱电解质与强电解质的本质区别是,强电解质在水溶液中能完全电离,而若电解质不可以。C选项若氢氰酸是强酸则PH为0小于3,所以氢氰酸为弱酸。所以答案选C,而D选项无论氢氰酸是强酸还是弱酸都恰好能完全发生反应。
本题难度:简单
4、选择题 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
A.稀释前,c(A)=10?c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7?mol/L
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
参考答案:A、稀释前,c(AOH)=0.1mol/L,c(BOH)>0.01mol/L,则c(AOH)<10c(BOH),故A错误;
B、稀释前A溶液中氢氧根离子浓度大于B溶液中;碱是抑制水的电离;稀释前,A溶液中由水电离出的OH-的浓度小于10-7?mol/L,故B错误;
C、M点AB溶液pH相同,氢氧根离子浓度相同,所以M点A、B两种碱溶液中阳离子的物质的量浓度相等,故C正确;
D、用醋酸中和A溶液至恰好完全反应时,醋酸是弱酸,生成的醋酸根离子水解显碱性,故D错误;
故选C.
本题解析:
本题难度:一般
5、填空题 (6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
参考答案:(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中离子浓度由大到小的顺序是 。(1) HA  H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
本题解析:
试题解析:(1)物质的量浓度体积相等HA和氢氧化钾混合,二者恰好反应生成盐,混合溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;(2)KA是强碱弱酸盐,其溶液呈碱性,要使酸碱混合溶液呈中性,则酸应该稍微过量,即酸的物质的量浓度应稍大于0.1mol/L,根据物料守恒可得:c(A-)+c(HA) >0.1mol·L-1;室温下,将pH=3的HA溶液进行稀释,稀释过程中,HA的电离平衡向正向移动,削弱氢离子浓度的减小程度,则稀释到原体积的10倍后,氢离子浓度大于原浓度的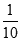 ,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
考点:弱电解质的电离、盐类水解
本题难度:困难