时间:2017-08-22 16:39:20
1、填空题 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料。
(1)与甲醇互为等电子体的有机物分子式为:_________________, 甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:______________________
(2)N2H4中N-N键键能__________(填“>”或“<” “=”) CH3CH3中C-C键键能,工业上将NH3或
(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为:_________、________,
1 mol(CH3)2CO中的π键数目为:_________。
(3)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。锰原子外围电子排布式为:____________。金属钛的晶胞是面心立方结构(如图),则钛晶体的1个晶胞中钛原子数为:
________,钛原子的配位数为:________。 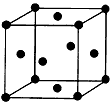
参考答案:(1)CH3SH;甲醇分子之间有氢键
(2)<;sp3杂化;sp2杂化;NA或6.02×1023
(3)3d54s2;4;12
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动
C.分子晶体的熔点很低,常温下都呈液态或气态
D.原子晶体中各相邻原子都以共价键结合
参考答案:D
本题解析:略
本题难度:一般
3、选择题 朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K时即具有超导性,该化合物的部分结构如图产所示: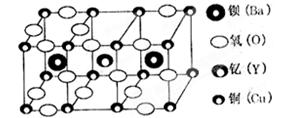
该化合物以Y2O3、BaCO3和CuO为原料,经研磨烧结而成,其原料配比(物质的量之比)为
A.1:1:1
B.1:4:6
C.1:2:3
D.2:2:3
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (6分)有下列晶体:①冰②金刚石③氩④过氧化钠⑤二氧化硅⑥氯化镁⑦纯醋酸⑧白磷⑨氯化铵⑩金属铝。用序号回答下列问题:
(1)在一定条件下能导电而不发生化学变化的是?;
(2)只含有极性共价键的分子晶体是 ?;
(3)固态时,晶体中只含有范德华力的是?;
(4)含共价键的离子晶体是 ?;
(5)只含有离子键的离子晶体是_______;
(6)只含有非极性键的原子晶体是_________;
参考答案:(1)⑩(2)①(3)③(4)④⑨(5)⑥(6)②
本题解析:金属导电,发生的是物理变化。分子晶体中存在分子间作用力,但干冰分子内还存在极性键,而稀有气体单质不存在化学键,白磷形成的具体是分子晶体,但分子内的化学键是非极性键。金刚石和二氧化硅属于原子晶体,但金刚石中碳和碳之间是非极性键,二氧化硅中则是极性键。过氧化钠和氯化铵属于离子晶体,前者含有离子键和非极性键,后者含有离子键和极性键。氯化镁也属于离子晶体,但只有离子键。纯醋酸形成的晶体属于分子晶体,分子既有非极性键又有极性键。
本题难度:一般
5、填空题 (10分)Ⅰ.(1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。下图是周期表中短周期的一部分,其中第一电离能最小的元素是_______. (填字母)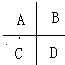
Ⅱ.(6分)德国和美国科学家首先制出由20个碳原子组成的
空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。请回答: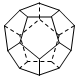
C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
Ⅲ. (3分)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。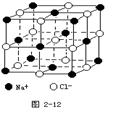 ?
?
(1)晶体中每个Na+同时吸引着______个Cl-,每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
参考答案:Ⅰ.C(1分) ;Ⅱ.12. (2分)30(2分);分子晶体(2分)。
Ⅲ.6(1分) ;6(1分) ;12(1分)
本题解析:Ⅰ.金属性越强,第一电离能越小。根据元素周期律可知C的金属性最强,所以第一电离能最小。
Ⅱ.根据结构图可知,每个碳原子形成3个C-C键,1个C-C键由2个电子形成,所以含有的棱边是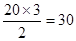 。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是
。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是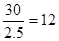 。该化合物中含有分子,属于分子晶体。
。该化合物中含有分子,属于分子晶体。
Ⅲ.根据晶胞的结构示意图可知每个钠离子同时吸引着6个氯离子,即上下、左右、前后各1个。反过来,每各氯离子同时吸引着6各钠离子。根据示意图可知晶体中在每个Cl-周围与它最接近且距离相等的Cl-位于面的中心处,共3各。由于每个顶点可以形成8各立方体,所以个数是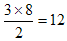 。
。
本题难度:一般