时间:2017-08-22 16:39:20
1、选择题 在以下的分子或离子中,空间结构的几何形状不是三角锥形的是(? )
A.NF3
B.CH3-
C.BF3
D.H3O+
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,会有Ag2CrO4沉淀产生
B.Si—O键的键能大于Si—Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点
C.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)
D.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系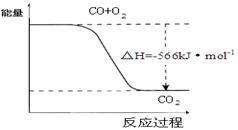
参考答案:A
本题解析:A、将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,溶液中Ag+和CrO42-浓度分别都是5×10-4mo1/L,所以此时溶液中c2(Ag+)·c(CrO42-)=(5×10-4)2×5×10-4=1.25×10-10>1.12×10-12,所以溶液中有Ag2CrO4沉淀产生,A正确;B、由于二氧化硅是原子晶体,而四氯化硅是分子晶体,所以二氧化硅的熔点高于四氯化硅的熔点,与键能大小无关系,B不正确;C、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,根据物料守恒可知溶液中2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),C不正确;D、根据热化学方程式可知,反应物是2molCO与1mol氧气化合生成2molCO2时放出的热量是566kJ,而图像中物质的物质的量不符合,D不正确,答案选A。
本题难度:一般
3、填空题 有A、B、C、D四种元素,A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体属于____晶体,其熔沸点比同周期的金属元素单质的要低,这是因为___________。
(2)B-的电子排布式为______,在CB3分子中C元素原子的原子轨道发生的是____杂化。
(3)C的氢化物的空间构型为________________。
(4)B元素的电负性____D元素的电负性(填“>”,“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:__________________。
参考答案:(1)金属;因为钠在同周期中的原子半径大,单位体积内的自由电子数目少,所以金属键弱,熔沸点低
(2)1s22s22p63s23p6;sp3
(3)三角锥型
(4)>;H2S+Cl2=2HCl+S↓
本题解析:
本题难度:一般
4、选择题 关于晶体和化学键关系的下列说法中,正确的是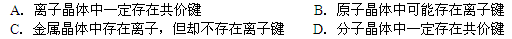
参考答案:C
本题解析:
正确答案:C
A不正确,NaCl晶体中只有离子键;B、不正确,原子晶体中只有共价键;C、正确;D、稀有气体为单原子分子,没有共价键。
本题难度:一般
5、填空题 1)图3-16为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有__________个与之紧邻且等距离的CO2分子。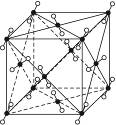
图3-16
在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为___________
_________,反应的化学方程式是______________________________。
(2)下列三种晶体①CO2 ②CS2 ③SiO2的熔点由高到低的顺序是__________>__________>__________(用序号填空),其原因是______________________________。
参考答案:(1)12 镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成
2Mg + CO2 2MgO + C
2MgO + C
(2)③ ② ① SiO2是原子晶体,CO2、CS2是分子晶体,所以SiO2熔点最高;CO2和CS2组成和结构相似,且CS2的相对分子质量大于CO2的相对分子质量,所以CS2的熔点高于CO2
本题解析:(1)以晶胞中的任意一个顶点为坐标原点,以通过该顶点的三条棱边为坐标轴建立起一个三维直角坐标系,在坐标原点的周围可以无隙并置8个晶胞,这样在每一个坐标轴上都可以看到有两个与坐标原点上的CO2分子等距离的CO2分子,但是这些CO2分子与坐标原点上的CO2分子的距离并不是最近的。与坐标原点上的CO2分子最近的CO2分子应该是每一个晶胞的面心上的,共有12个这样的CO2分子。
(2)一般来说,原子晶体的熔点高于分子晶体的熔点,因为原子晶体熔化时要破坏共价键,而分子晶体熔化时只是克服分子间作用力,分子间作用力比共价键弱得多。如果同为分子晶体,当分子的组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高。
本题难度:简单