时间:2017-08-22 16:15:55
1、选择题 室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
| 序号 | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
参考答案:B
本题解析:A项,由于氯化铵水解呈酸性,故在①、②中分别加入氯化铵晶体,两溶液的pH均减小,不正确;B项,分别稀释100倍,由于②中氢氧化钠为强电解质,而①中存在氨水的电离平衡,故正确;C项,将①、④两溶液等体积混合后,氨水过量,溶液呈碱性,根据电荷守恒判断,故不正确;D项,将溶液②和③等体积混合后,由于醋酸是弱酸,反应中过量较多,反应后溶液呈酸性,故不正确。
本题难度:一般
2、选择题 对于常温下pH为4的醋酸溶液,下列叙述正确的是( )
A.该溶液的c(H+)为1×10-4mol?L-1
B.该溶液lmL稀释至100mL后,pH等于6
C.向该溶液中加入等体积、pH为10的氢氧化钠溶液恰好完全中和
D.该溶液中醋酸电离出的c(H+)与水电离出的c(H+)的比值为106
参考答案:A、常温下pH=4的醋酸溶液中c(H+)=1×10-4 mol/L,故A正确;
B、该溶液lmL稀释至100mL,加水稀释促进醋酸的电离,氢离子的物质的量增大,所以PH变化小于2个单位,即PH<6,故B错误;
C、常温下pH=4的醋酸溶液中醋酸溶液的浓度大于1×10-4mol/L,与等体积、pH=10的NaOH溶液混合,NaOH的浓度为于1×10-4mol/L,则酸过量,故C错误;
D、常温下pH为4的醋酸中c(H+)=1×10-4 mol?L-1,则溶液中c(OH-)=Kwc(H+)=1×10-10 mol?L-1,醋酸中氢氧根离子为水电离的,则溶液中c(OH-)水=c(H+)水=1×10-10 mol?L-1,所以醋酸电离出的c(H+)与水电离出的c(H+)的比值为106,故D正确;
故选AD.
本题解析:
本题难度:一般
3、选择题 某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- ?HA- H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是
A.在0.1 mol·L-1的H2A溶液中,c(H+)> 0.12 mol·L-1
B.在0.1 mol·L-1的Na2A溶液中,c(A2-)+ c(HA-)+ c(Na+)=" 0.2" mol·L-1
C.分别将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7
D.0.1 mol·L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)
参考答案:C
本题解析:A. 在0.1 mol·L-1的H2A溶液中,首先发生电离:H2A = H+ + HA- ,这步是完全的、彻底的,然后发生电离:HA- H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液中,根据物料守恒可得c(A2-)+ c(HA-)+ c(Na+)= 0.3mol·L-1.错误。C. 由于在NaHA的溶液中存在HA-
H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液中,根据物料守恒可得c(A2-)+ c(HA-)+ c(Na+)= 0.3mol·L-1.错误。C. 由于在NaHA的溶液中存在HA- H+ + A2- (Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7。正确。D. 在0.1 mol·L-1的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H +)>c(A2-)。故溶液中的离子浓度的关系是c(Na+)>c(HA-)>c(H +)>c(A2-)>c(OH-)。错误。
H+ + A2- (Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7。正确。D. 在0.1 mol·L-1的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H +)>c(A2-)。故溶液中的离子浓度的关系是c(Na+)>c(HA-)>c(H +)>c(A2-)>c(OH-)。错误。
本题难度:一般
4、填空题 (14分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦HCl ⑧NaOH ⑨Cl2 ⑩酒精 请按要求回答下列问题(填编号):
(1) 属于电解质的有 ;(2)属于非电解质的有: ;
(3)属于强电解质的有 ;(4)属于弱电解质的有 ;
(5)请分别写出NH3·H2O ,NaHCO3的电离方程式: ; 。
参考答案:(共14分)
(1) ①②③⑤⑥⑦⑧ (2)④⑩ (3)①②⑤⑦⑧ (4)③⑥ (各2分)
(5)NH3·H2O 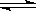 NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
本题解析:(1) 属于电解质的有 ①②③⑤⑥⑦⑧ ;(2)属于非电解质的有:④⑩;
(3)属于强电解质的有①②⑤⑦⑧;(4)属于弱电解质的有③⑥;
(5)NH3·H2O的电离方程式:NH3·H2O 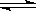 NH4 ++OH-;
NH4 ++OH-;
NaHCO3的电离方程式 NaHCO3=Na ++ HCO3-。
考点:电解质
点评:水溶液中或熔融状态下能够电离的化合物称为电解质,常见的酸、碱、盐都是电解质如:碳酸、硫酸、硝酸、磷酸、乙酸(醋酸)都是酸,氢氧化钡、一水合氨、氢氧化铜都是碱,碳酸钠、碳酸钙、碳酸氢钠、硫酸铜晶体都是盐,它们都是电解质。在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质。(大多数的有机物都是非电解质)(单质,混合物不管在水溶液中或熔融状态下是否[1]能够导电,都不是电解质或非电解质。)
在水溶液中几乎完全发生电离的电解质叫做强电解质;在水溶液中不完全发生电离的电解质叫做弱电解质。
电解质与非电解质的区别
电解质
非电解质
相同点
均为化合物
不同点
水溶液或熔融状态能导电
水溶液和熔融状态都不能导电
本质区别
在水溶液里或熔融状态下自身能发生电离
在水溶液里或熔融状态下自身不能发生电离
所含物质类型
酸, 碱, 盐 , 活泼金属氧化物,水
非金属氧化物,非酸性气态化合物,部分有机物
电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等。凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等。
能导电的化合物不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素。例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。硫酸钡难溶于水,溶液中离子浓度很小,其水溶液不导电,似乎为非电解质。但熔融的硫酸钡却可以导电。因此,硫酸钡是电解质。碳酸钙和硫酸钡具有相类似的情况,也是电解质。从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,但溶的那部分是完全电离的,所以也是电解质。因为溶解是绝对的,不溶是相对的。没有绝对不溶的物质。
本题难度:一般
5、选择题 下列有关化学反应过程或实验现象的解释中正确的是
[? ]
A.纳米铁粉的直径为20 nm,所以纳米铁粉属于胶体
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.向滴有酚酞的Na2CO3溶液中加入BaCl3溶液,溶液褪色,说明BaCl2有酸性
参考答案:C
本题解析:
本题难度:一般