时间:2017-08-22 16:15:55
1、选择题 盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是(?)
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO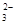 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
2、选择题 在已达到电离平衡的0.1 mol·L一的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是? (? )
A.加少量盐酸
B.加热
C.加少量醋酸钠晶体
D.加氢氧化钠
3、填空题 (12分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K=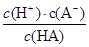 ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
4、选择题 用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
[? ]
5、选择题 稀氨水中存在下述平衡: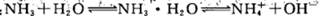 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是
A.加浓氨水
B.升高温度
C.加NH4Cl溶液
D.加NaOH溶液