时间:2017-08-22 15:45:14
1、选择题 用Na2CO3标准溶液滴定未知浓度盐酸,导致测定结果偏高的操作有(?)
A.滴定前锥形瓶用蒸馏水润洗过
B.滴定前锥形瓶中加入待测盐酸后又加蒸馏水
C.滴定前读数方法正确,滴定后俯视读数
D.滴定前尖嘴中气泡未排除即进行滴定,滴定后尖嘴无气泡
参考答案:D
本题解析:略
本题难度:简单
2、实验题 锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下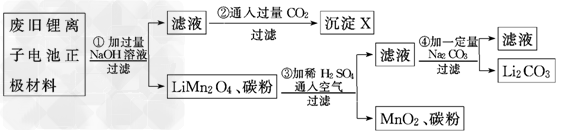
(1)第②步反应得到的沉淀X的化学式为________.
(2)第③步反应的离子方程式是_______________________________________________.
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_____________________________.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_________________________________________________________.
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1?g,第③步反应中加入20.0?mL?3.0?mol/L的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________g?Na2CO3参加了反应.
参考答案:(1)Al(OH)3
(2)4LiMn2O4+4H++O2==8MnO2+4Li++2H2O
(3)烧杯、漏斗、玻璃棒 玻璃棒下端靠在滤纸的单层处,导致滤纸破损,漏斗中液面高于滤纸边缘(其他合理答案均可)
(4)6.4(或6.36)
本题解析:
本题难度:一般
3、实验题 (1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。请完成相关的实验步骤和现象。可选试剂:①0. 1mol·L-1KI溶液;②0. 1mol·L-1FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L-1 KI溶液,再滴加5~6滴0. 1mol·L-1FeCl3溶液;
②充分反应后,将溶液分成三份;
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂____________,现象_______________,说明______________________。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: 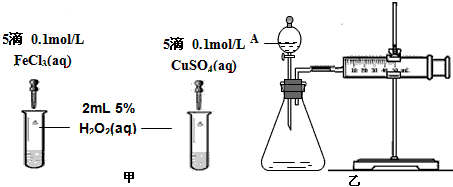
①定性分析:如图甲可通过观察_______________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是______________________。
参考答案:(1)KSCN溶液;溶液显血红色;Fe3+没有反应完(或KI和FeCl3的反应有一定的限度)
(2)①溶液中气泡产生的速率;排除氯离子的干扰(其它合理答案也给分) ;②收集40mL气体所需的时间
本题解析:
本题难度:困难
4、选择题 以下是某学生利用集气瓶、导管、稀硫酸、四氯化碳一起设计的一套能“防止倒吸”,并能吸收氨气的装置。下列说法错误的是(?)
A.a为稀硫酸
B.b为四氯化碳
C.若吸收后的溶液中溶质为单一物质时,则不一定显酸性。
D.该吸收过程,表现了硫酸的酸性
参考答案:C
本题解析:稀硫酸极易和氨气结合,若直接接触容易发生倒吸现象,而题目中说能防止倒吸并能吸收氨气装置,因此可以知道a为稀硫酸,b为四氯化碳,该吸收过程,表现了硫酸的酸性。若吸收后溶质为单一物质时,可以推测为硫酸铵或硫酸氢铵,则一定显酸性。
本题难度:简单
5、实验题 (16分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。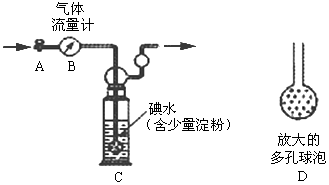
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
?。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:?。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量?
(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如以下流程图所示: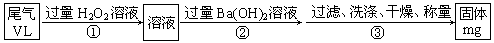
(4)写出步骤②中反应的化学方程式?。
(5)步骤③中洗涤沉淀的方法是?。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为?(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
?。
参考答案:(1)增大气体与溶液的接触面积,有利于SO2与碘水充分反应(2分)
(2)酸性高锰酸钾溶液等(2分)
(3)偏低(2分)
(4)H2SO4+Ba(OH)2==BaSO4↓+2H2O(3分)
(5)向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次? (2分)
(6)22.4m / (233V)(3分)
(7)不合理。BaSO3被部分氧化为BaSO4(2分)
本题解析:甲.(1)根据多孔球泡D的结构可知可以增大反应物的接触面积,使反应更充分。
(2)SO2具有还原性,还是一种酸性氧化物,所以可以用酸性高锰酸钾溶液或碱液等。
(3)没有及时关闭活塞A,则通过的气体就偏多,测定结果就偏低。
乙.(4)双氧水具有氧化性,可以把SO2氧化生成硫酸,而双氧水被还原生成水。所以在反应②就是硫酸和氢氧化钡的中和反应。
(5)沉淀应该在过滤器中进行,具体操作是向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次。
(6)硫酸钡是mg,则根据硫原子守恒可知SO2的物质的量是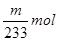 。所以SO2的体积分数是
。所以SO2的体积分数是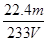
丙.(7)由于SO2和氢氧化钡反应生成的亚硫酸钡易被氧化生成硫酸钡,因此最后得到的固体是混合物,所以方案是不正确的。
本题难度:一般