时间:2017-08-22 15:45:14
1、简答题 CoCl2?6H2O是一种饲料营养强化剂.以含钴(Co)废料(含少量Fe、Al等杂质)制取CoCl2?6H2O的一种新工艺,流程如图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 开始沉淀 2.3 7.5 7.6 3.4 完全沉淀 4.0 9.7 9.2 5.2 |
参考答案:(1)金属和盐酸反应生成氯化物,和硝酸反应生成硝酸盐,同时生成一氧化氮,导致氯化物中含有硝酸盐杂质,且生成有毒气体,污染环境,
故答案为:减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐;
(2)废料加入盐酸后生成氯化物,然后加入双氧水,二价铁离子被双氧水氧化生成三价铁离子,根据沉淀的PH值表格知,当溶液的PH值为5.2时,铁离子和铝离子被完全沉淀,当溶液的PH值为7.6时,钴离子才开始产生沉淀,所以要想将铁离子、铝离子和钴离子分离,溶液的pH值应该不小于5.2不大于7.6,
故答案为:5.2≤a≤7.6;
(3)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,故答案为:蒸发浓缩、冷却结晶;
(4)根据题意知,CoCl2?6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2?6H2O需减压烘干,
故答案为:降低烘干温度,防止产品分解;
(5)根据CoCl2?6H2O的组成分析,造成产品中CoCl2?6H2O的质量分数大于100%的原因可能是:1、含有杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,故答案为:可能是含有杂质,也可能是失去部分水;
(6)根据CoCl2?6H2O的性质选取方法,CoCl2?6H2o熔点86℃,易溶于乙醚,所以将产品溶于乙醚,过滤后再蒸馏,从而获得较纯净的CoCl2?6H2O,
故答案为:将产品溶于乙醚,过滤后再蒸馏.
本题解析:
本题难度:一般
2、实验题 固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ?Ⅲ?Ⅳ?Ⅱ?V?Ⅵ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
参考答案:(1)分液漏斗 (2)碱石灰;3CuO+2NH3 3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
(4)Mg3N2
本题解析:(1)带有活塞的漏斗是分液漏斗。(2)根据实验流程图可知,用红色石蕊试纸检验的是氨气,氨气是一种碱性气体,用碱石灰干燥氨气;氨气具有还原性,可将黑色的CuO还原为红色的Cu,自身被氧化为N2;尾气中的氨气被浓硫酸吸收,最后N2用排水法收集。(3)氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝。
(4)0.56 L M即N2的物质的量为0.025 mol,则化合物A中N的质量为0.7 g,则另一种元素的质量为1.8 g,经过对A中未知元素的化合价讨论可得,只能是+2价的Mg,故该物质是Mg3N2。
本题难度:一般
3、简答题 理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象.针对这一问题,研究性学习小组开展了探究性实验.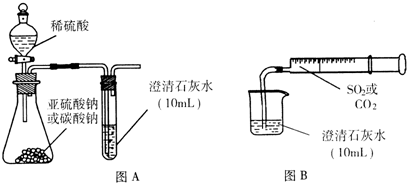
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通入CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象.
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象.当以相同速率分别通入CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快.
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通入澄清石灰水,依次发生的反应有:(用离子方程式表示)______;______.
(2)实验I中,通入SO2不能出现浑浊的原因可能是:______.
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有______.
①SO2在水中溶解度比CO2大.
②相同状态下,SO2的密度比CO2的密度大.
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l?mol亚硫酸电离产生的H+离子浓度大于l?mol碳酸电离产生的H+离子浓度.
④SO2有毒和刺激性气味,CO2无毒和无刺激性气味.
⑤相同条件下,1mol?SO2与足量石灰水反应生成CaSO3的速率大于1mol?CO2与足量石灰水反应生成CaCO3的速率.
⑥相同条件下,1molCaSO3被1mol?SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率.
参考答案:(1)二氧化碳与氢氧化钙溶液反应生成碳酸钙和水、碳酸钙与水与二氧化碳反应生成碳酸氢钙,而SO2和CO2均属于非金属氧化物,某些性质相似,因此二氧化硫通入澄清石灰水生成亚硫酸钙沉淀和水,反应的化学方程式为SO2+Ca(OH)2═CaSO3↓+H2O,继续通沉淀溶解反应方程式为:CaSO3+H2O+SO2=Ca(HSO3)2,所以离子反应方程式为SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-,
故答案为:SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-;
(2)二氧化硫与澄清的石灰水反应,如果二氧化硫过量,会发生CaSO3+H2O+SO2=Ca(HSO3)2,亚硫酸氢钙易溶于水,所以,当实验操作通入二氧化硫较快较多,澄清的石灰水相对比较少,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀,
故答案为:澄清的石灰水比较少,通入二氧化硫较快较多,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀;
(3)①1体积水中溶解二氧化硫为40体积,1体积水中溶解二氧化碳为2体积,所以,SO2在水中溶解度比CO2大,在溶液中,参加反应的二氧化硫比二氧化碳多,故①正确;
②密度大小与在溶液中的气体的物质的量的多少无关,所以相同状态下,SO2的密度比CO2的密度大与反应现象无关,故②错误;
③二氧化硫与水反应生成亚硫酸,二氧化碳与水反应生成碳酸,亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l?mol亚硫酸电离产生的H+离子浓度大于l?mol碳酸电离产生的H+离子浓度,与碱反应,前者电离出的氢离子多,反应快,故③正确;
④二氧化硫气体与二氧化碳的气体与碱反应,本质为酸性气体和碱反应,其气味和毒性与碱反应快慢无关,故④错误;
⑤相同条件下,相同的物质的量与碱反应,反应快,能说明SO2产生现象比CO2快,所以,1mol?SO2与足量石灰水反应生成CaSO3的速率大于1mol?CO2与足量石灰水反应生成CaCO3的速率正确,故⑤正确;
⑥相同条件下,相同的物质的量的气体与沉淀,溶解得快,说明SO2产生现象比CO2快,所以,1molCaSO3被1mol?SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率,正确,故⑥正确;
故答案为:①③⑤⑥.
本题解析:
本题难度:一般
4、实验题 为了测定酶的专一性,我们做如下实验:
①用清水 将口漱净,口内含一块消过毒的脱脂棉,用镊子取出脱脂棉,将其中的唾液收集到小烧杯中;
②稀释;
③取两支洁净的试管,编上号,做如下操作:向试管1注入可溶性淀粉溶液2 mL,加入稀释唾液2 mL, 向试管2注入蔗糖溶液2 mL,加入稀释唾液 2 mL;
④轻轻振荡并保持试管的下半部分浸入 37℃温水中10 min;
⑤加入2 mL Cu(OH)2悬浊液;
⑥将试管下半部分放在酒精灯上均匀加热,煮沸5~10 min;
⑦10 min后1号试管中有红色沉淀 (Cu2O)生成。
请回答:
(1)为什么要将试管的下半部分浸到37℃的温水中______________?
(2)对步骤⑦,说明现象出现的原因___________。
(3)比较试管1、2的最终现象,本实验能说明什么问题_____________?
参考答案:(1)使酶具有最高的催化效率。
(2)nH2O+ 2( C6 H10O5)n→nC12H22O11,Cu(OH)2悬浊液与麦芽糖作用生成Cu2O红色沉淀。
(3)2号试管无明显现象,说明酶有专一性。
本题解析:
本题难度:一般
5、实验题 某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应。
可能发生的反应有:
2Fe3++SO32-+H2O==2Fe2++SO42-+2H+(氧化还原反应)
2Fe3++3SO32-+6H2O==2Fe(OH)3(胶体)+3H2SO3(水解反应)
为了证明反应的实际情况,同学们设计并实施了下列实验,请填写下列空白:
实验I:
学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是____。
实验Ⅱ:
①取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 ____。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是___。将溶液分成两等份,其中一份加入KSCN稀溶液,溶液变成血红色,反应的离子方程式为____。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是____。
②换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。与实验Ⅱ产生的现象完全相同。由上述实验得出的结论是____。
实验Ⅲ:
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是____。从形式上看,Na2CO3和Na2SO3相似。但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ____;②____。
参考答案:实验I:
检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:
①氢氧化铁胶体(或胶体); 先产生红褐色 淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生;
Fe3++ 3SCN-==Fe(SCN)3? ;Ba2++SO42-==BaSO4↓
②Fe3+与SO32-同时发生氧化还原反应和双水解反应
实验Ⅲ:
2Fe3++ 3CO32-+3H2O==2Fe(OH)3↓+3CO2↑ ;
①SO32-有较强的还原性,CO32-没有还原性;②SO32-水解能力较CO32-小
本题解析:
本题难度:一般