时间:2017-08-10 02:06:22
1、选择题 氢氧燃料电池以 H2 为还原剂, O2为氧化剂,电极为多孔镍,电解液为 30% 的 KOH 溶液,下列有关叙述正确的是 ( )
①负极反应为 4OH-→O 2+ 2H 2 O+ 4 e-?
②负极反应为 H 2+ 2OH-→ 2H 2 O+ 2 e-?
③工作时正极区 pH 升高,负极区 pH 降低 ?
④工作时溶液中阴离子移向正极?
A.③④
B.②③
C.②④
D.①④
参考答案:B
本题解析:略
本题难度:简单
2、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
参考答案:(1)由化学能转变为电能(1分) 由a到b(1分)
(2)2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O(2分)
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或增大电极上H2、O2气体的浓度,加快反应速率。(2分)
(4)①Li(1分) H2O (1分) ②16(2分)
本题解析:
试题解析:(1)氢氧燃料电池是利用了原电池的工作原理,所以是把化学能转化为电能的装置。在装置中,电子的流向是从负极流向正极,图中a为负极,b为正极,所以电子从a流向b。
(2)负极是氢气发生氧化反应,结合电解质溶液,电极反应式为2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O。
(3)由题目中所述,铂吸附气体的能力强,性质稳定,所以电极表面镀铂粉的目的是增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或者是增大电极上H2、O2气体的浓度,加快反应速率。
(4)①还原剂是指元素化合价升高的物质,在Ⅰ中Li的化合价升高,所以Li是还原剂;氧化剂是指元素化合价降低的物质,在Ⅱ中H2O中氢元素的化合价降低,所以H2O作氧化剂。
②放出的H2的物质的量为10mol,由于能量转化率为80%,实际参加反应的H2的物质的量为10mol×80%=8mol, H2的物质的量为8mol, H2-2e-=2H+则导线上通过的电子的物质的量为8mol×2=16mol。
考点:考查氢氧燃料电池的工作原理、电子流向、相应计算
本题难度:一般
3、填空题 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C O O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
 O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4 O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
 学式)
学式)参考答案:(16分)⑴-116 kJ·mol-1 (2分)
⑵-651 kJ·mol-1 (2分)
单位体积供能多;密度大易于运输;单位产能耗氧量较少
(1分,其它合理答案均给分)
⑶K=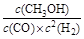 (1分)
(1分)
降低温度;增加反应气体的压强;将反应生成的甲醇及 时冷凝从反应体系中移去。
时冷凝从反应体系中移去。
(3分,其它合理答案均给分)
增加反应气体的压强 (1分,其它合理答案均给分)
⑷① 如图: (4分)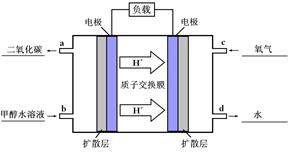
②CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+ (2分)
本题解析:略
本题难度:困难
4、选择题 瑞典ASES公司设计的用于驱动潜艇的液氨-液氧燃料?电池示意图如下,有关说法正确的是
A.电池总反应为:4NH3 + 3O2 = N2 + 6H2O
B.电池工作时,OH-向负极移动
C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O
D.电流由电极1经外电路流向电极2
参考答案:B
本题解析:A、该化学方程式没有配平,错误;B、电池工作时,阴离子向负极移动,正确;C、该电池的电解质溶液为NaOH溶液,所以电极2发生的电极反应为:O2+2H2O+4e?=4OH?,错误;D、电流由正极流向负极,所以电流由电极2经外电路流向电极1,错误。
本题难度:一般
5、选择题 随着国民经济的不断发展,绿色环保可持续发战略展要求废电池必须进行集中处理,其首要原因是( )
A.利用电池外壳的金属材料
B.回收其中的石墨电极
C.防止电池中的汞、镉和铅等重金属离子对土壤和水的污染
D.不使电池中渗泄的电解液腐蚀其它物品
参考答案:回收废电池的首要原因是防止废电池中渗漏出的重金属离子对土壤和水源的污染,而对废电池的综合利用是第二位的,故C正确;
故选C.
本题解析:
本题难度:简单