时间:2017-08-10 02:06:22
1、填空题 近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的?极(填“正”或“负”),负极反应式为?.用这种方法处理SO2废气的优点是?.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是?.
②下列有关说法正确的是?.
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是?.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式?.
参考答案:(共15分)
(1) 负(2分)?SO2+2H2O-2e-=SO42-+4H+?(2分)
利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。(2分)
(2)①防止亚硫酸铵被氧化(1分)?②ABCD(4分)
③K2SO4在有机溶剂乙二醇中溶解度小,能充分析出(2分)?
④4(NH4)2SO3+2NO2=4(NH4)2SO4+N2(2分)
本题解析:
(1)原电池负极发生氧化反应,正极发生还原反应,依据元素化合价变化可知,二氧化硫中硫元素化合价升高,失电子发生氧化反应。因此应将SO2通入电池的负极,电极反应为:SO2+2H2O-2e-=SO42-+4H+;此方法的优点是污染小,生成产物可以循环利用,可以回收有效能;
(2)①向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,防止亚硫酸根被氧化,以更好的得到亚硫酸铵晶体;
②A、依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙,正确;
B、依据流程图中的反应物和生成物,结合元素化合价变化分析,正确;
C、防止碳酸氢铵在温度过高时分解得不到需要的目标产物,正确;
D、氯化铵是一种氮肥,正确;
③硫酸钾在40%的乙二醇溶液中溶解度比在水中的小,有利于析出;
④二氧化氮具有强氧化性能氧化亚硫酸铵,生成硫酸铵,本身被还原为氮气,原子守恒配平书写出的化学方程式为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
本题难度:困难
2、计算题 用Pt电极电解浓度为17%的饱和硝酸银溶液,当金属银完全析出时,阳极上放出5.6 L气体(标准状况),电解后溶液的密度为1.038 g·cm-3。试计算:
(1)电解前原硝酸银溶液的总质量是多少?电解析出的银多少克?
(2)电解前硝酸银的溶解度是多少?
(3)电解后所得溶液的质量分数和物质的量浓度各为多少?
参考答案:(1)1000 g? 108 g? (2)20.48 g? (3)7.1%? 1.17 mol·L-1
本题解析:(1)由4AgNO3+2H2O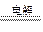 4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
电解前硝酸银溶液的质量设为x。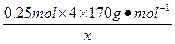 =17%,x="1000" g
=17%,x="1000" g
(2)AgNO3溶液的溶解度为=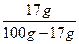 ×100 g="20.48" g
×100 g="20.48" g
(3)根据上述关系式可知电解生成HNO3 1 mol。
w(HNO3)=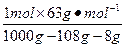 ×100%=7.1%
×100%=7.1%
c(HNO3)=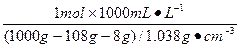 ="1.17" mol·L-1
="1.17" mol·L-1
本题难度:简单
3、选择题 下列四个图像的有关说法正确的是
A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液
D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液
参考答案:D
本题解析:A、由图像可知反应物总能量比生成物总能量高,反应是放热反应,△H<0,错误; B、由图像可知,压强越大,B的体积分数越小,说明增大压强,平衡向右移动,所以D一定不是气体,错误;C、体积和pH均相同的HCl、CH3COOH两种溶液中醋酸物质的量大,因锌足量,所以氢气的体积与酸的物质的量成正比,a表示醋酸,错误;D、向碳酸钠溶液中滴加盐酸,先无气体后产生气体。向碳酸氢钠溶液中滴加盐酸,立即产生气体,正确。
本题难度:一般
4、填空题 某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 1 Mg、Al 稀盐酸 偏向Al 2 Al、Cu 稀盐酸 偏向Cu 3 Al、C(石墨) 稀盐酸 偏向石墨 4 Mg、Al 氢氧化钠溶液 偏向Mg 5 Al、Zn 浓硝酸 偏向Al |
参考答案:(1)金属与酸构成的原电池中,活泼金属作负极,则实验1中Mg的活泼性大于Al,所以Al作正极,而实验2中Al的活泼性大于Cu,所以Al作负极,故答案为:不相同;
(2)实验3中Al为负极,电极反应为2Al-6e-═2Al3+,石墨为正极,其电极反应为6H++6e-═3H2↑,电池总反应为2Al+6HCl═2AlCl3+3H2↑,
故答案为:负;2Al-6e-═2Al3+;正;6H++6 e-═3H2↑;2Al+6HCl═2AlCl3+3H2↑;
(3)实验4中Mg不与naOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极,负极反应为Al-3e-+4OH-═AlO2-+2H2O,
故答案为:负极;Mg不与naOH溶液发生反应,而Al与NaOH溶液反应;Al-3e-+4OH-═AlO2-+2H2O;
(4)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由正极流向负极,所以电流计指针偏向铝,
故答案为:Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由正极流向负极,所以电流计指针偏向铝.
本题解析:
本题难度:一般
5、选择题 下列关于原电池的叙述中,正确的是
A.原电池中,正极就是阳极,负极就是阴极
B.形成原电池时,在负极上发生氧化反应
C.原电池工作时,溶液中的阳离C子向负极移动
D.电子从负极经电解质溶液流向正极
参考答案:B
本题解析:A错误,原电池中,正极就是阴极,负极就是阳极;B正确,C错误,原电池工作时,溶液中的阳离子向正极移动,D错误,电子从负极经外电路流向正极。
点评:本题考查了原电池的基础知识,属于对基本知识的考查,该题不难。
本题难度:一般