时间:2017-08-10 02:06:22
1、选择题 根据反应:2Ag++Cu=Cu2++2Ag,设计如图所示原电池,下列说法错误的是(?)
A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为:Ag++e-=Ag
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铜失去电子,发生氧化反应,做原电池的负极。溶液中的银离子得到电子,在正极发生还原反应。因此根据装置图可知,X是正极,金属性弱于铜的,或用石墨做电极,电解质溶液是硝酸银,A、C、D正确,B不正确,答案选B。
点评:该题是基础性试题的考查,侧重对学生灵活运用原电池原理解决实际问题的能力的培养,有利于调动学生的学习兴趣和学习积极性。明确原电池的工作原理是解题的关键。
本题难度:一般
2、选择题 下列各个装置中能组成原电池的是?
[? ]
A﹑
B﹑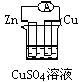
C﹑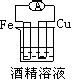
D﹑
参考答案:B
本题解析:
本题难度:简单
3、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH4-+ 8OH-+8e-→BO2-+ 6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
参考答案:B
本题解析:A.通入硼氢化合物NaBH4的电极为负极,通入H2O2的电极为正极。A.电池放电时Na+会移向负电荷较多的正极。即从a极区移向b极区。错误。B.电极b采用MnO2,MnO2是H2O2分解产生氧气的催化剂。因此MnO2既作电极材料又有催化作用。正确。C.该电池的负极反应为:BH4-+ 8OH--8e-→BO2-+ 6H2O。错误。D.根据电子转移数目相等可知:每消耗3 mol H2O2,转移的电子为6 mol.错误。4和H2O2作原料的燃料电池的工作原理的知识。
本题难度:一般
4、选择题 科学家近年来研制出一种新型细菌燃料电池,利用细菌将 机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电。电池负极反应为?
[? ]
参考答案:C
本题解析:
本题难度:一般
5、简答题 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.
(1)导线将容器A和B连接时,Zn接______,Cu接______(填“a”或“b”)
(2)容器A中Cu极发生的电极反应为______.
(3)B装置叫______,溶液中的NO3-向______极移动(填“a”或“b”).
(4)若b极观察到有无色无味气泡产生,经过一段时间后,停止反应并搅拌均匀,溶液的pH值将______(填“升高”、“降低”或“不变”),加入一定量的______后(填化学式),溶液能恢复至与反应前完全一致.若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:______.
Ⅱ.炒菜的铁锅没有洗干净容易生锈.用必要的文字和有关化学方程式说明铁锈是如何形成的______.
参考答案:I..(1)用导线连接后,左边烧杯中能自发的进行氧化还原反应,锌易失电子而作负极,铜作正极,要使a极上析出铜,则a极应该是阴极,连接原电池负极锌,铜连接b,
故答案为:a;b;
(2)容器A中铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)B连接外接电源,属于电解池,电解时阴离子硝酸根离子向阳极b移动,故答案为:电解池;b;
(4)若b极观察到有无色无味气泡产生,b电极上氢氧根离子放电生成氧气,则溶液中氢离子浓度增加,溶液的pH减小,根据析出什么加入什么的原则加入物质,则应该加入氧化铜而使溶液恢复原来状态,
若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:铜作阳极,阳极上铜失电子生成铜离子进入溶液,阴极上析出铜,所以电解质溶液中铜离子浓度基本不变,
故答案为:降低;CuO;B装置是电镀池;
II.铁、碳和氯化钠溶液构成原电池,铁作负极而被腐蚀,碳作正极,正极上氧气得电子生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化生成氢氧化铁,氢氧化铁失水生成铁锈,反应方程式为:2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:铁、碳和氯化钠溶液构成原电池,铁作负极而被腐蚀,碳作正极,正极上氧气得电子生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化生成氢氧化铁,氢氧化铁失水生成铁锈,反应方程式为:2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+2H2O+O2=4Fe(OH)3.
本题解析:
本题难度:一般