时间:2017-08-09 23:43:30
1、实验题 氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: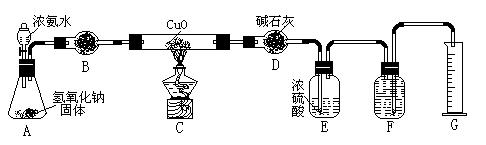
(1)写出氨气与氧化铜反应的化学方程式:?。
(2)在A的锥形瓶中放入NaOH固体的目的是?。
(3)在干燥管B中不能选用的干燥剂是?(填序号);
A.碱石灰
B.生石灰
C.五氧化二磷
D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是:?;
( 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.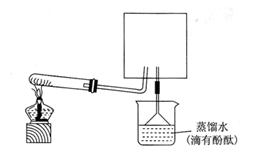
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)? ??。
??。
2、选择题 下列实验装置正确且能达到相应的实验目的的是?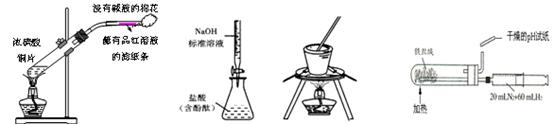
A.制取SO2并检验SO2的漂白性
B.测定盐酸浓度检验
C.从食盐水中提取NaCl
D.合成氨并氨的生成
3、选择题 根据下列实验现象,所得结论错误的是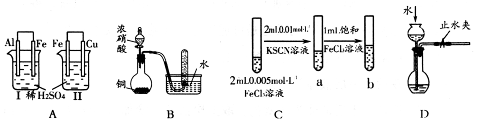

4、选择题 断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )
A.加热观察是否有气体放出
B.加盐酸并观察生成气体的速度
C.Ba(OH)2溶液,观察有无白色沉淀生成
D.加CaCl2溶液,观察有无白色沉淀生成
5、选择题 配制一定物质的量浓度的NaOH溶液,下列情况,会使配制的结果偏高的是
A.用滤纸称量NaO H固体
H固体
B.未洗涤烧杯和玻璃棒
C.容量瓶中原来含有少量蒸馏水
D.定容时俯视刻度线观察液面