时间:2017-08-08 06:27:24
1、计算题 (4分)在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
参考答案:因为体积之比是物质的量之比,所以
N2?+? 3H2? ?2NH3
?2NH3
起始量(mol)? 1? 3? 2
转化量(mol)? x? 3x? 2x
平衡量(mol)? 1-x? 3-3x? 2x
因此平衡时氮气和氢气的体积之比仍然是1︰3
所以氮气的体积分数为(100%-12%)÷=22%
氢气是66%。
本题解析:考查可逆反应的应该计 算。
本题难度:一般
2、选择题 今有X(g)+Y(g) 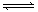 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是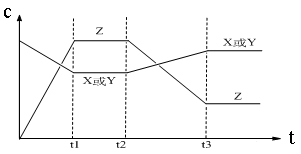
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
参考答案:D
本题解析:根据图像可知,t2时反应物的浓度逐渐增大,而生成物的浓度逐渐减小,因此改变的条件一定不是浓度或压强。由于平衡向逆反应方向移动,而正方应是体积不变的、放热的可逆反应,因此改变的条件只能是升高温度,升高温度平衡向吸热的方向移动,答案选D。
本题难度:一般
3、选择题 一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)反应热和化学平衡常数为(? )
2N2(g)+6H2(g)反应热和化学平衡常数为(? )
A.2△H和2K
B.-2△H和 K2
C.-2△H和 K-2
D.2△H和-2K
参考答案:C
本题解析:反应热和化学计量数成之比,即反应热是-2△H;平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,选项C正确,答案选C。
本题难度:简单
4、选择题 下列措施或事实不能用勒夏特列原理解释的是 (? )
A.新制的氯水在光照下颜色变浅
B.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
C.在合成氨的反应中,降温或加压有利于氨的合成
D.H2、I2、HI平衡混合气加压后颜色变深
参考答案:D
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系,所以选项A、B、C都是正确的。D中反应前后体积不变,增大压强,浓度增大,颜色加深,但平衡不移动,不能用勒夏特列原理解释,答案选D。
点评:该题是基础性试题的考查,试题难易适中,灵活性强,注重能力的考查和训练。有利于培养学生的灵活应变能力和逻辑推理能力。
本题难度:简单
5、选择题 下图是温度和压强对X+Y Z反应影响的示意图,下列叙述正确的是
Z反应影响的示意图,下列叙述正确的是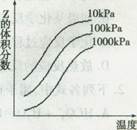 ?
?
A.X和Y中只有一种为气态,z为气态
B.X、Y、Z均为气态
C.上述可逆反应的正反应为放热反应
D.上述反应的逆反应的△H>0
参考答案:A
本题解析:
原题方程式有错,应为:X+Y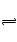 2Z
2Z
正确答案:A
A、由图,加压后Z的体积分数减少,平衡逆向移动,逆向体积缩小,X和Y中只有一种为气态,z为气态;
B、不正确;
C、不正确,由图升高温度,Z增加,平衡正向移动,正向△H>0,吸热反应,D也不正确。
本题难度:一般