时间:2017-08-08 06:14:34
1、填空题 有关FeSO4的转化关系如下图所示(无关物质已略去)。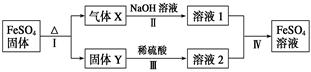
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应? b.复分解反应? c.置换反应? d.化合反应?e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
参考答案:(1)SO2、SO3(2分)? SO3+BaCl2+H2O =BaSO4↓+2HCl(3分)
(2)ae(2分)
(3)取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+(3分)
(4)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+(3分)
本题解析:
X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。确定成分为SO2、SO3;且产生沉淀的方程式为SO3+BaCl2+H2O =BaSO4↓+2HCl;
反应Ⅰ的反应类型属于分解反应、氧化还原反应;
固体Y中铁为+3,溶液2中检验Fe3+取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+;
则反应Ⅳ中生成FeSO4的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。
本题难度:一般
2、实验题 氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.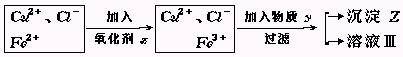
↓蒸发结晶
CuCl2·2H2O(纯)
(1)加入氧化剂X的目的是?
(2)下列氧化剂中最适合本实验的是?
A.H2O2
B.KMnO4
C.NaClO
D.K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是?和?.
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
参考答案:(1)使溶液A中的Fe2+氧化成Fe3+;? (2)A? (3)Y:CuO或Cu(OH)2? Z:Fe(OH)3
本题解析:本题是对一个实验问题进行理论分析.
解答本题的关键是理解题中提供的一条中学未曾接触的信息的含意.由于Fe2+沉淀为Fe(OH)2的PH值与Cu2+沉淀为Cu(OH)2的PH较大,而与Fe3+沉淀为Fe(OH)3的PH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的PH使铁以Fe(OH)3沉淀形式而被除去.为了使加入的氧化剂不带入新的杂质,显然用H2O2最好.出于同样的考虑,加入y调节溶液PH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使PH值升高太多而使Cu2+沉淀.
本题难度:一般
3、选择题 下列说法不正确的是( )
A.赤铁矿的主要成分是Fe2O3
B.铝土矿的主要成分是Al2O3
C.工业制备氯气主要采用电解饱和食盐水的方法
D.把铁矿石冶炼成铁的过程中,还原剂主要是焦炭
参考答案:D
本题解析:
本题难度:一般
4、填空题 H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
?(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是?;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体?g;
?(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是?,其物质的量之比是?;
参考答案:(6分)
(1)2︰1?(1分)
(2)4?(2分)
(3)NO、NO2?(1分)? 4︰3?(2分)
本题解析:略
本题难度:一般
5、选择题 下列说法正确的是( )
A.含金属元素的离子一定是阳离子
B.向新制的FeCl2溶液中滴加NaOH溶液,有红褐色沉淀生成
C.氯水和过氧化钠都具有漂白作用,其漂白原理相似
D.如果将过量的二氧化锰与20mL、12mol?L-1的盐酸混合加热,充分反应生成氯气的物质的量一定为0.06mol
参考答案:C
本题解析:
本题难度:简单