时间:2017-08-08 06:14:34
1、选择题 进行下列各反应,要得到相同的Cu(NO3)2,消耗HNO3的物质的量最大的是( )
A.铜与浓硝酸反应
B.铜和稀硝酸反应
C.氧化铜和硝酸反应
D.氢氧化铜和硝酸反应
参考答案:A
本题解析:根据题目条件,结合选项可知制取等量的硝酸铜消耗硝酸最多的是铜和浓硝酸的反应。
本题难度:简单
2、实验题 (16分)铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。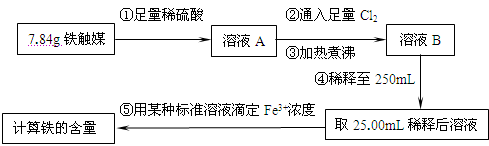
(1)步骤④后面需用?(填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有?会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| ? | ? |

参考答案:(1)酸式滴定管(或移液管)(2分)(2)FeCl2或者FeSO4或者Fe2+(2分)
(3)
实验操作
预期现象和结论
取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象。(2分)
若溶液显红色,后红色褪去,则溶液B中含Cl2(2分);
若溶液变红后不褪色,则溶液B不含有Cl2(2分)
?
(加入品红稀溶液也得分)
(4)防止空气中的CO2和水蒸气进入B中(2分)(5)Fe4O5或2FeO·Fe2O3(4分)
本题解析:(1)要量取25.00mL稀释后溶液,则需要滴定管(或移液管)。由于溶液显酸性,因此应该用酸式滴定管。
(2)氯气具有强氧化性,如果氯气不足,则溶液中就可能含有未被氧化的亚铁离子。
(3)氯气具有氧化性,能氧化碘化钾。但由于溶液中含有铁离子,铁离子也能氧化碘化钾,所以不能选择淀粉碘化钾。由于氯气溶液中显酸性,同时生成你的次氯酸还具有强氧化性,具有漂白性,据此可以检验。即取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象。若溶液显红色,后红色褪去,则溶液B中含Cl2;若溶液变红后不褪色,则溶液B不含有Cl2。
(4)CO还原铁的氧化物生成单质铁和CO2,CO2被碱石灰吸收,据此可以计算铁的氧化物中氧元素的质量。但由于空气中含有CO2和水蒸气,也能被碱石灰吸收干扰实验,所以C中碱石灰的作用是防止空气中的CO2和水蒸气进入B中。
(5)碱石灰吸收反应中生成的CO2,所以碱石灰增加的质量就是CO2的质量。则根据“干燥管B”增重11.0g可知,反应中生成CO2的物质的量=11.0g÷44g/mol=0.25mol。CO结合氧化物中氧元素生成CO2,所以氧化物中氧元素的质量=0.25mol×16g/mol=4.0g,则氧化物中铁元素的质量=15.2g-4.0g=11.2g,物质的量=11.2g÷56g/mol=0.2mol,因此氧化物中铁和氧的原子个数之比=0.2:0.25=4:5,所以该铁触媒的化学式可表示为Fe4O5或2FeO·Fe2O3。
本题难度:困难
3、填空题 (12分)⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__?g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: ?2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
①?当 a / b =1时,_______________________?______;
②?当a / b≥3/2时,________________?_____________。
⑶观察如下反应,总结规律,然后完成下列问题:
①?Al(OH)3 +H2O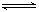 Al(OH)4- + H+? ②NH3+H2O
Al(OH)4- + H+? ②NH3+H2O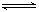 NH4+?+ OH_
NH4+?+ OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式________________________?__
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式___________?_________________
参考答案: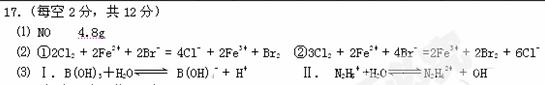
本题解析:略
本题难度:困难
4、选择题 铜和浓硝酸反应产生的气体,用排水法收集到a L气体(标准状况),被还原的硝酸是(?)
A.a/22.4 mol
B.a/11.2 mol
C.3a/22.4 mol
D.3amol
参考答案:C
本题解析:铜和浓硝酸反应产生的气体是NO2,用排水法收集到的气体是NO,占原气体体积的1/3,所以,实际生成的NO2是3aL,则被还原的硝酸应是3a/22.4 mol。
本题难度:简单
5、填空题 (8分)A、F、G是单质,其中A、F是金属单质,且A是现在用途最广用量最大的金属。F具有黄色的焰色反应,G是黄绿色气体;B、C、D、E是化合物;E到D的现象为白色沉淀变为灰绿色,最后变为红褐色,它们之间存在如下图所示的转化关系(生成物没有全部写出):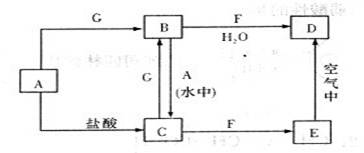
(1)推断:A__________F_______(填化学式)
(2)写出E→D的化学方程式_____?_______。
(3)写出C→B的离子方程式____________?____________。
参考答案:⑴Fe,Na
⑵4Fe(OH)2+O2+2H2O==4Fe(OH)3?
⑶2Fe2++Cl2==2Fe3++2Cl-
本题解析:A是现在用途最广用量最大的金属,A是Fe;F具有黄色的焰色反应,F具有Na元素;G是黄绿色气体,G是Cl2;E到D的现象为白色沉淀变为灰绿色,最后变为红褐色,涉及到:4Fe(OH)2+O2+2H2O==4Fe(OH)3
则: A、Fe;B、FeCl3;C、FeCl2;D、Fe(OH)3、E、Fe(OH)2;F、NaOH;G、Cl2
A、Fe;B、FeCl3;C、FeCl2;D、Fe(OH)3、E、Fe(OH)2;F、NaOH;G、Cl2
本题难度:一般