时间:2017-08-08 06:14:34
1、实验题 (19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。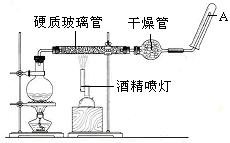
(1)写出该反应的化学方程式?,其中氧化剂是?,还原剂是?。8.4g铁粉参加反应,转移电子?mol。
(2)玻璃管中石棉绒的作用是?,实验开始时应先点燃?,实验结束时应先熄灭?。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶里应事先放置?,其作用是?。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是?,若溶液未变红色则说明硬质试管中固体物质的
成分是?。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是?
?(用离子方程式表示)。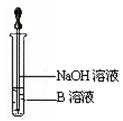
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式??,
?。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有?性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是?,
并且配制含Fe2+的盐溶液时应加入少量?。
2、选择题 将铁屑溶于过量盐酸,再加入下列物质不会有三价铁生成的是(?)
A.H2SO4
B.氯水
C.Zn(NO3)2
D.H2O2
3、选择题 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则金属C元素所在的主族是
A.ⅠA? B.ⅡA? ? C.ⅢA? D.无法确定
4、填空题 某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为:
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有??(填仪器名称)。
(2)操作II中必须用到的仪器是?。
A.50mL量筒
B.100mL量筒
C.50mL酸式滴定管
D.50mL碱式滴定管
(3)反应①中,加入足量H2O2溶液反应的离子方程式?。
(4)检验沉淀中SO42-是否冼涤干净的操作?
?。
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,还应进行的操作是?
?。
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为44.8g,则样品中铁元素的质量分数=?(保留一位小数)。
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行??。(填“可行”或“不可行”)
5、选择题 标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是
A.所得沉淀为0.05 mol的BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672<a<0.896