时间:2017-08-08 05:24:01
1、选择题 下列表示物质结构的化学用语或模型正确的是
[? ]
A.8个中子的碳原子的核素符号:12C
B.HF的电子式: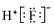
C.Cl-离子的结构示意图: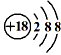
D.CH4分子的比例模型:
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列含有非极性键的共价化合物是(? )
A.HCl
B.Na2O2
C.C2H2(两个碳原子间成叁键)
D.CH4
参考答案:C
本题解析:HCl中只含有极性键,是共价化合物;Na2O2中Na+与过氧根离子(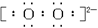 )之间形成离子键,
)之间形成离子键,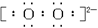 中O原子与O原子之间形成非极性键,但Na2O2是离子化合物;C2H2(H—C≡C—H)中C、H之间形成极性键,C、C之间形成非极性键,是共价化合物;CH4中只含有极性键,是共价化合物。
中O原子与O原子之间形成非极性键,但Na2O2是离子化合物;C2H2(H—C≡C—H)中C、H之间形成极性键,C、C之间形成非极性键,是共价化合物;CH4中只含有极性键,是共价化合物。
本题难度:简单
3、选择题 下列有关冰的说法中,正确的组合是(?)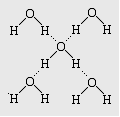
①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④晶胞与金刚石相似;?
⑤与干冰的晶胞相似;
⑥每个水分子平均拥有四个氢键;
⑦冰的结构是由氢键的方向性和饱和性所决定的;
⑧冰中H和O原子之间的作用力不是σ键就是氢键
A.除⑤⑥外
B.除④⑦⑧外
C.除④⑤⑥⑧外
D.全对
参考答案:A
本题解析:水分子中,每个水分子平均拥有2个氢键,⑥不正确。⑤也错误的,其余都是正确的,答案选A。
本题难度:简单
4、填空题 (4分)下面是你熟悉的物质:
①O2② 金刚石 ③ NaBr ④ H2SO4⑤ Na2CO3⑥ K2S?⑦NaHSO4
小题1:这些物质中,只含共价键的是_______________;只含离子键的是___________;既含共价键又含离子键的是_______________。
小题2:将NaHSO4溶于水,写出其电离方程式______________________________。
参考答案:
小题1:①②④? ③⑥? ⑦⑤?
小题2:NaHSO4==Na++H++SO42-
本题解析:(1)考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。所以①~⑦中含有的化学键分别为非极性键、非极性键、离子键、极性键、离子键和极性键、离子键、离子键和极性键。
(2)磷酸氢钠是电解质溶于水完全电离,电离方程式为NaHSO4==Na++H++SO42-。
本题难度:一般
5、简答题 请按要求完成下列各题:
(1)MgCl2的电子式是______;丙氨酸的结构简式是______.
(2)1gC2H2完全燃烧生成CO2和液态水,放出49.94kJ热量.乙炔在氧气中完全燃烧的热化学方程式是______.
(3)在一定条件下,分子式为C3H4O2的羧酸和某醇反应生成分子式为C5H8O2的酯,写出该反应的化学方程式(有机物写结构简式,下同)______.
(4)在一定条件下,乙烯和丙烯按1:1的物质的量比反应生成聚乙丙烯的化学方程式是______.
(5)依据酸碱质子理论,HCO3-可以看作是______.
参考答案:(1)镁失去2个电子形成阳离子,氯原子得到电子形成阴离子,电子式为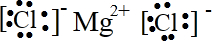 ;丙氨酸的结构简式为
;丙氨酸的结构简式为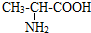 ,
,
故答案为: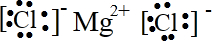 ;
;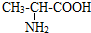 ;
;
(2)1gC2H2在氧气中燃烧生成CO2和液态水,放出49.94kJ热量,26g即1molCH4在氧气中燃烧生成CO2和液态水,放出1294.8kJ热量,
则热化学方程式为:C2H2(g)+52O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol,
故答案为:C2H2(g)+52O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol;
(3)C3H4O2的羧酸和某醇反应生成分子式为C5H8O2的酯,该反应的化学方程式:CH2=CHCOOH+CH3CH2OH催化剂
本题解析:
本题难度:一般