时间:2017-08-08 05:24:01
1、填空题 有X、Y、Z、W四种短周期主族元素,原子序数依次增大.X元素与其它元素不在同一周期.Y、Z在同周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.W原子的最外层电子数是核外电子层数的2倍.请回答:
(1)W在元素周期表位置______.
(2)写出X与Z形成的10电子阳离子的化学式______.
(3)由上述四种元素中的某两种元素所形成的具有漂白作用的物质的化学式是:______(任意写一种).
(4)W的最高价氧化物的水化物有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为______.
(5)由X、Y、Z、W四种元素组成的多种无机酸酸式盐,写出其中一种与足量的NaOH溶液在加热条件下反应的离子方程式为:______.
2、选择题 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是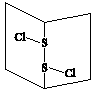
[? ]
A.S2Cl2的电子式为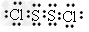 ?
?
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O==SO2↑+3S↓+4HCl
3、选择题 下列说法不正确的是
[? ]
A.共价化合物和离子化合物中,一定都含有非金属元素
B.一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
C.全部由非金属构成的化合物一定不存在离子键
D.共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
4、填空题 我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为?。
(2)S与O为同主族元素,其中电负性较大的是?;H2S分子中S原子杂化轨道类型为?;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:?。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体??(填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为?;欲比较CaO与NaCl的晶格能大小,需考虑的数据是?。
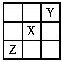
5、选择题 已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,下列说法中不正确的是( )
A.Y、Z的原子序数之和可能是2a
B.Y的原子序数可能是a-17
C.Z的原子序数可能是a+31
D.X、Y、Z一定都是短周期元素