时间:2017-08-08 05:08:54
1、选择题 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- 据此判断以下叙述中错误的是
NH4++NH2- 据此判断以下叙述中错误的是
[? ]
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列有关实验原理、方法和结论都正确都是( )
A.向某FeCl3溶液中加入KSCN溶液,观察到溶液呈血红色,说明该FeCl3溶液中不含Fe2+离子
B.先用水将pH试纸湿润,再测量某未知溶液的pH,若pH=1,说明该溶液中c(H+)=0.1mol?L-1
C.在0.1mol?L-1?Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应
D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
参考答案:A、向氯化铁溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中含有三价铁离子,要检验该溶液中是否含有二价铁离子要用酸性高锰酸钾溶液而不是硫氰化钾溶液,根据酸性高锰酸钾溶液是否褪色判断是否含有二价铁离子,故A错误.
B、如果先用蒸馏水润湿PH试纸,再测量溶液的PH值,会导致溶液的浓度降低,测得溶液的PH值偏大,故B错误.
C、盐类水解中存在水解平衡,当升高温度平衡向吸热方向移动,在0.1mol?L-1?Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,平衡向正反应方向移动,所以说明盐类水解反应是吸热反应,故C正确.
D、当体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,HA的物质的量浓度大于HB的,所以说明酸性:HA<HB,故D错误.
故选C
本题解析:
本题难度:简单
3、选择题 在含有酚酞的0.1mol/L氨水中加少量的NH4Cl晶体,则溶液颜色( )
A.变蓝色
B.变深
C.变浅
D.不变
参考答案:C
本题解析:氨水中存在平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,加少量氯化铵晶体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减少,溶液颜色变浅。
NH4++OH-,加少量氯化铵晶体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减少,溶液颜色变浅。
考点:弱电解质的电离平衡
点评:勒沙特列原理同样适用于弱电解质电离平衡。
本题难度:一般
4、选择题 某一元弱酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数(忽略水电离)比为a:b,则HA的电离度(即转化率)是
A.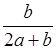 ×100%
×100%
B. ×100%
×100%
C. ×100%
×100%
D.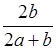 ×100%
×100%
参考答案:A
本题解析:电离度是指弱电解质已电离的物质的物质的量与弱电解质原来的物质的量之比。
HA? ?H+?+? A-
?H+?+? A-
起始n: (a+b/2)mol? 0? 0
变化n:? b/2mol? b/2mol? b/2mol
平衡n:? amol? b/2mol? b/2mol
因此,HA的电离度(即转化率)是: ×100%
×100%
本题难度:一般
5、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向生成CH3COOH的方向移动
B.加入少量NaOH固体,平衡向电离的方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向电离的方向移动
参考答案:B
本题解析:A.加入水时,由于生成物的浓度减小的多,反应物的浓度减小的少,所以电离平衡向电解质电离的方向移动。错误。B.加入少量NaOH固体,由于发生反应:OH-+H+=H2O。使c(H+)减小。减小生成物的浓度,化学平衡正向移动,即平衡向电离的方向移动。正确。C.加入少量0.1mol·L-1HCl溶液,c(H+)增大,平衡逆向移动,减小这种增大的趋势,但是总的来说,溶液中c(H+)还是增大。错误。D.加入少量CH3COONa固体,溶液则c(CH3COO-)增大,电离平衡逆向移动,对醋酸的电离起到了抑制作用。正确。
本题难度:一般