时间:2017-08-08 04:42:04
1、选择题 NaF、NaI、和MgO均为离子晶体,有关数据如下表:
| 物?质 | ① NaF | ② NaI | ③ MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10m) | 2.31 | 3.18 | 2.10 |
参考答案:A
本题解析:离子化合物形成的离子晶体中,离子键的键长越短,阴、阳离子所带电荷越多,则晶体的熔点越高。根据表中数据可知,阴离子半径是I->F->O2-,阳离子半径是Na+>Mg2+,所以根据三种物质所带电荷为③>②=①,键长:③<①<②可知,三种化合物熔点由高到低的顺序是③>①>②,答案选A。
本题难度:一般
2、简答题 下列是部分金属元素的电离能
| X | Y | Z 第一电离能(kJ/mol) 520.2 495.8 418.8 |
参考答案:(1)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比,X、Y、Z这三种阳离子电荷数相等,离子半径逐渐增大,所以其熔点从小到大的顺序是ZCl<YCl<XCl,故答案为:ZCl<YCl<XCl;
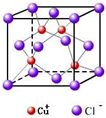
(2)铜是29号元素,其原子核外有29个电子,根据构造原理知其基态原子核外电子排布式为:[Ar]3d104s1,根据晶胞结构知,面心上的氯离子连接4个亚铜离子,
故答案为:[Ar]3d104s1,4.
本题解析:
本题难度:简单
3、选择题 下列晶体分类中正确的一组是( )
| ? | 离子晶体 | 原子晶体 | 分子晶体 |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | SiO2 | CO2 |
| D | Ba(OH)2 | 金刚石 | 玻璃 参考答案:C 本题解析:Ar是分子晶体,A不正确;硫酸是分子晶体,石墨是混合型晶体,B不正确;玻璃是混合物,不是晶体,答案选C。 本题难度:一般 4、实验题 (6分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为: |
参考答案:(1)C?(2)酸式滴定管;碱式滴定管的橡皮管会溶于苯而变形
(3)不能;水会溶解NaCl,不能测出NaCl固体的体积?(4)NA=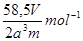
本题解析:(1)由于容量瓶能准确量取一定体积的溶液,所以答案选C。
(2)苯是有机溶剂,碱式滴定管的橡皮管会溶于苯而变形,所以应该用酸式滴定管。
(3)由于水能溶解NaCl,不能测出NaCl固体的体积,所以不能用水代替苯。
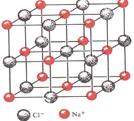
(4)根据晶胞可知,该晶胞中含有4和氯离子和4个钠离子,晶胞的边长是2acm,所以有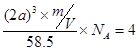 ,解得NA=
,解得NA=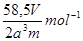 。
。
本题难度:一般
5、选择题 下列说法正确的是(?)
A.某晶体固态不导电,水溶液能导电说明该晶体是离子晶体
B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力。
C.区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验
D.任何晶体中,若含有阳离子也一定含有阴离子
参考答案:C
本题解析:考查晶体的性质和判断。区分离子晶体还是分子晶体可以通过熔融时能否导电来验证。分子晶体在熔融时不能导电,A不正确。在分子晶体内还可以存在共价键,B不正确。D不正确,例如金属晶体中存在阳离子,但没有阴离子。所以正确的答案是C。
本题难度:简单