时间:2017-08-08 03:56:04
1、选择题 将相同物质的量的镁和铝混合,取相同质量的该混合物4份,分别加入到足量的下列溶液中,充分反应后,放出H2最多的是
[? ]
A.3?mol/LHCl? ?
B.4?mol/LHNO3?
C.8?mol/LNaOH?
D.18?mol/LH2SO4
参考答案:A
本题解析:
本题难度:一般
2、选择题 现有100mL溶质为MgCl2和AlCl3的混合液,其中c(Cl-)=1.5mol/L,c(Mg2+)=0.3mol/L。若不考虑水解因素,则要使其中的Mg2+全部转化为沉淀而分离出来,至少需要3mol/L的NaOH的体积是
[? ]
A、15mL?
B、50mL?
C、60mL?
D、100mL
参考答案:C
本题解析:
本题难度:一般
3、选择题 在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4mol/L、0.1 mol/L,向该混合液中加入
1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是
[? ]
A.0.15mol/L
B.0.225 mol/L
C.0. 35 mol/L
D.0. 45 mol/L
参考答案:B
本题解析:
本题难度:一般
4、计算题 将0.1mol的镁铝混合物溶于100mL 2mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。
请回答:

参考答案:(1)0.06;440
(2)400
(3)1/2≤a<1
本题解析:
本题难度:一般
5、计算题 把4.7g某主族元素R的最高价氧化物R2O溶于95.3?g水中,生成溶液的溶质质量分数为5.6%。?
试求:
(1)R的相对原子质量,并确定R在元素周期表中的位置。 ?
(2)已知R2O与水作用生成ROH,试写出ROH的电子式。 ?
(3)另一元素A与R同主族,每12gA的氢氧化物跟0.75?mol/L?400?mL的盐酸恰好完全中和,求?
A的相对原子质量。 ?
(4)相同质量的A、R单质,分别跟足量的水反应,生成H2的体积(相同条件)哪种更多?反应哪种更剧烈?
参考答案:(1)39;在第四周期第IA族?
(2)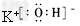 ?
?
(3)23?
(4)钠与水反应生成的H2多;钾反应剧烈
本题解析:
本题难度:一般