时间:2017-08-06 11:34:55
1、选择题 下列物质中既含有共价键又含有离子键的是(? )
A.NaI
B.CaCl2
C.NO2
D.KNO3
参考答案:D
本题解析:NaI只有离子键;CaCl2只含离子键;NO2只含极性键;KNO3中有离子键和极性键;
本题难度:简单
2、填空题 A、B、C、D?4种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2.A、C原子的核外次外层电子数为8.D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸.则:
(1)B、D分别是______、______.
(2)A的离子结构示意图为______,C的原子结构示意图为______.
(3)C、D的气态氢化物稳定性由强到弱的顺序为:______(写化学式,用“>”表示强弱).
(4)D元素的最高价氧化物对应的水化物的化学式为______.
参考答案:A、B、C、D?4种元素的原子序数均小于18,最高价等于最外层电子数,由B的原子核外次外层电子数为2,最高正价为4,则B为碳元素;A、C原子的核外次外层电子数为8,最高正价分别为1、5,则A为钠元素,C为磷元素;D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸,该酸为高氯酸,且Cl的最高价为+7,所以D为氯元素,
(1)B为碳元素,元素符号为C,D为氯元素,元素符号为Cl,故答案为:C;Cl;
(2)A为钠元素,则钠离子的质子数为11,有2个电子层,最外层电子数为8,其离子结构示意图为
,C为磷元素,其质子数为15,有3个电子层,最外层电子数为5,其原子结构示意图为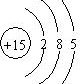
,故答案为:
;
;
(3)C为P,D为Cl,非金属性Cl>P,则气态氢化物稳定性由强到弱的顺序为HCl>PH3,故答案为:HCl>PH3;
(4)因D的最高价为+7价,则最高价氧化物对应的水化物的化学式为HClO4,故答案为:HClO4.
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E为原子序数依次增大的短周期元素.A元素的原子核外只有1个电子,B的单质是空气中含量最多的气体;C原子的最外层电子数是次外层电子数的3倍;含D元素的物质灼烧时使火焰呈黄色;E的单质既能与酸反应又能与碱反应.则C的元素符号为______;D的原子结构示意图为______;A和B形成的化合物BA3的电子式为______;E在周期表中的位置是______;D和C形成的化合物与水反应的化学方程式为(写出一个即可)______;E的单质与氢氧化钠溶液反应的离子方程式为______.
参考答案:A、B、C、D、E为原子序数依次增大的短周期元素.A元素的原子核外只有1个电子,则A为氢元素;B的单质是空气中含量最多的气体,则B为氮元素;C原子的最外层电子数是次外层电子数的3倍,C原子只能有2个电子层,最外层电子数为6,则C为氧元素;含D元素的物质灼烧时使火焰呈黄色,则D为Na;E的单质既能与酸反应又能与碱反应,可推知E为Al,则:
C的元素符号为O;D的原子结构示意图为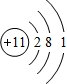 ;A和B形成的化合物为NH3,其电子式为
;A和B形成的化合物为NH3,其电子式为 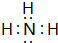 ;E为Al,在周期表中的位置是第三周期第ⅢA族;D和C形成的化合物为氧化钠或过氧化钠,与水反应的化学方程式为:Na2O+H2O=2NaOH(或2Na2O2+2H2O=4NaOH+O2↑);E为Al,单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
;E为Al,在周期表中的位置是第三周期第ⅢA族;D和C形成的化合物为氧化钠或过氧化钠,与水反应的化学方程式为:Na2O+H2O=2NaOH(或2Na2O2+2H2O=4NaOH+O2↑);E为Al,单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:O;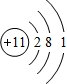 ;
;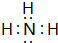 ;第三周期第ⅢA族;Na2O+H2O=2NaOH(或2Na2O2+2H2O=4NaOH+O2↑);2Al+2OH-+2H2O=2AlO2-+3H2↑.
;第三周期第ⅢA族;Na2O+H2O=2NaOH(或2Na2O2+2H2O=4NaOH+O2↑);2Al+2OH-+2H2O=2AlO2-+3H2↑.
本题解析:
本题难度:一般
4、选择题 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N—N—N键角都是108.1°,下列有关 N(NO2)3的说法正确的是( )。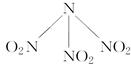
A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该分子中的中心氮原子采取sp3杂化
D.15.2 g该物质含有6.02×1022个原子
参考答案:C
本题解析:同种原子构成的共价键为非极性键,A错误;中心N原子以SP3杂化,分子为四面体结构,四个N原子不可能共平面,B错C对;15.2g该物质含有1mol原子,D错。
点评:历年高考中,物质的结构主要考核共价键(极性与非极性)、原子共平面(直线)、中心原子的杂化类型等。难度中等。
本题难度:简单
5、填空题 下列物质中含有极性键的是______,含有非极性键的是______,属于非极性分子的是______,属于极性分子的是______.(用序号填空)
①CO2?②H2O?③CH4?④N2?⑤H2?⑥Na2O2?⑦NaOH?⑧HF?⑨NH3.
参考答案:①CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
②H2O中含有极性键,空间结构为V型,属于极性分子;
③CH4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
④N2中只含非极性键,属于非极性分子;
⑤H2中只含非极性键,属于非极性分子;
⑥Na2O2中含离子键和非极性键,属于离子化合物;
⑦NaOH中含离子键和极性键,属于离子化合物;
⑧HF中含有极性键,负电荷的中心不重合,具有一定的极性,属于极性分子;
⑨NH3中含有极性键,空间结构为三角锥型,属于极性分子;
故答案为:①②③⑦⑧⑨;④⑤⑥;①③④⑤;②⑧⑨.
本题解析:
本题难度:一般