时间:2017-08-06 11:34:55
1、选择题 下列分子中,含有非极性键的化合物是(? )
A.H2
B.CO2
C.H2O
D.C2H4
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列分子中,所有原子都满足最外层为8电子结构的是
[? ]
A.CH4
B.NO
C.CCl4
D.SO2
参考答案:C
本题解析:
本题难度:简单
3、选择题 关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是(?)
A.N5+共有34个核外电子
B.N5+中氮原子间以离子键结合
C.化合物N5ASF6中AS的化合价为+1价
D.化合物N5ASF6为离子化合物
参考答案:AD
本题解析:氮元素的原子序数为7,则1个氮原子核外电子数为7,5个氮原子核外电子数为35,失去1个电子变成N5+的核外电子数为34,故A正确;N5+中氮元素与氮元素都是非金属,它们之间只能以共价键结合,不能以离子键结合,因为它们得电子能力相同,故B错;由于氟在化合物中只有—1价,由5个氮原 91EXAm.org子形成的N5+的总化合价为+1,化合物N5ASF6中各元素化合价代数和为0,则砷元素的化合价为+5价,故C错;化合物N5ASF6由N5+和ASF6—构成,阴阳离子之间以离子键结合,因此该化合物是离子化合物,故D正确。
本题难度:一般
4、选择题 用下图表示的一些物质或概念间的从属关系中正确的是
| ? | X | Y | Z |
| A | 混合物 | 胶体 | 分散系 |
| B | 纯净物 | 碱 | 纯碱 |
| C | 化合物 | 电解质 | BaSO4 |
| D | 化学反应 | 非氧化还原反应 | 复分解反应 |

参考答案:CD
本题解析:略
本题难度:简单
5、填空题 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。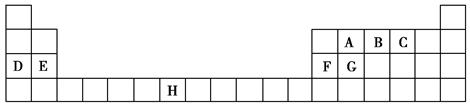
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。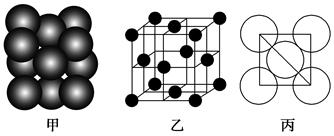
参考答案:(共11分) (1)Na<Al<Si<N(1分)
(2)1s22s22p63s23p63d54s2(或[Ar]3d54s2)(1分)
(3)sp3(1分) 直线形(1分)
(4)高 (1分)NaCl为离子晶体,而SiCl4为分子晶体(2分)
(5)原子(1分) A (1分)? (6)12(1分) 4(1分)
本题解析:(1)非金属性越强,第一电离能越大。所以大小顺序是Na<Al<Si<N。
(2)H是锰元素,根据构造原理可知,基态原子电子排布式为1s22s22p63s23p63d54s2(或[Ar]3d54s2)。
(3)碳的最简单氢化物是甲烷,由于碳原子中没有孤对电子,所以是正四面体形结构,采用sp3杂化。碳的最高价氧化物是CO2,属于直线型结构。
(4)钠的氯化物是氯化钠,形成的晶体是离子晶体,熔点高。硅的氯化物是四氯化碳,形成的晶体是分子晶体,熔点低。
(5)硅和氧形成的氧化物是二氧化硅,形成的晶体是原子晶体。硅原子和氧原子全部以单键相连,所以是σ键,答案选A。
(6)F是Al,根据晶胞的结构可知,配位数是3×8÷2=12。含有的原子数是8×1/8+6×1/2=4。
本题难度:一般