时间:2017-08-06 11:32:22
1、填空题 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是?。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个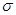 键和1个大
键和1个大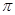 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元?素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

参考答案:(1) A D? 2分 (2)3d54s2? 2分?Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。) 2分?(3)d区 1分 (4) TiO2?2分
(5)① H<C<N<O? 2分 ②CO2(N2O)、SCN-2分 ③ N≡C—O—H? 2分
本题解析:(1)A、由于氧元素的电负性大,所以CH2O与水分子间能形成氢键,A正确;B、CH2O分子是平面型结构,中心原子碳原子是sp2杂化,CO2分子是直线型结构,中心原子碳原子采用sp杂化,B不正确;C、C6H6结构是正六边形结构,属于非极性分子。C6H6分子中碳原子是sp2杂化,其中每个碳原子与碳原子形成2个σ键,与氢原子形成1个σ键,所以共含有12个σ键和1个大π键,C不正确;D、CO2晶体是分子晶体,而二氧化硅晶体是原子晶体,所以CO2的熔点、沸点都比二氧化硅晶体的低,D正确,答案选AD。
(2)Mn是25号元素,则根据核外电子排布规律可知,Mn元素价电子排布式为3d54s2;由于Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。),所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。
(3)区的名称来自于安装构造原理最后填入电子的轨道名称,Ti是22号元素,其价电子排布式为3d24s2,所以Ti元素位于d去。
(4)根据晶胞结构可知,氧原子位于面心处与晶胞内,Ti原子位于顶点处和体心处,所以根据均摊原理可知,结构中氧原子的个数=4×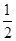 +2=4个,Ti原子个数=1+8×
+2=4个,Ti原子个数=1+8×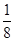 =2,所以化学式为TiO2。
=2,所以化学式为TiO2。
(5)①非金属性越强,电负性越小。因此同周期自左向右电负性逐渐增大,则H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O。
②价电子数与原子数分别都相等的互为等电子体,则与CNO-互为等电子体微粒的化学式为CO2(N2O)、SCN-等。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,因此分子中C与N形成三键,其余均是单键,所以氰酸的结构式N≡C—O—H。
本题难度:一般
2、选择题 下列叙述正确的是
[? ]
A.燃烧后能产生CO2和H2O的有机物是碳氢化合物
B.甲烷是一种无色、难溶于水的有毒气体
C.甲烷和白磷都是正四面体结构,键角均为109°28"
D.CH2Cl2为极性分子,而CH4是非极性分子
参考答案:D
本题解析:
本题难度:简单
3、填空题 (11分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中。试回答
(1)写出C原子的价层电子轨道表示式: ;D原子的价层电子排布式:___________,E的原子结构示意图:___________;
(2)B位于元素周期表的第?族,A、B形成原子个数比1:1且直线形分子的结构式: ;
(3)C的基态原子核外有 种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式: ,其中的阳离子与阴离子的个数比是 ;
(5)F的固态氧化物的用途有________ ___(说出一种)。F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是? ?。
参考答案:(11分,除最后一空2分,其余每空1分)
⑴N: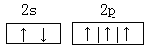 、O:2s22p4、Na:
、O:2s22p4、Na:
⑵ IVA、H-C≡C-H;
⑶7;⑷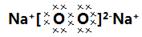 、2:1;
、2:1;
⑸耐火材料(砖),人造刚玉,冶炼铝等、4Al+3TiO2+3C 2Al2O3+3TiC
2Al2O3+3TiC
本题解析:根据元素的性质及结构可知,A、B、C、D、E、F六种短周期元素分别是H、C、N、O、Na、Al。
(1)根据构造原理可知,氮原子的价层电子轨道表示式为 。氧原子的价电子的电子排布式为2s22p4。钠原子的结构示意图为
。氧原子的价电子的电子排布式为2s22p4。钠原子的结构示意图为 。
。
(2)碳元素位于第 IVA,A、B形成原子个数比1:1且直线形分子是乙炔,结构式为H-C≡C-H。
(3)氮原子核外有7个电子,就有7种不同运动状态的电子。
(4)钠燃烧生成过氧化钠,电子式为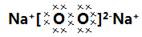 ,其中的阳离子与阴离子的个数比2︰1。
,其中的阳离子与阴离子的个数比2︰1。
(5)氧化铝的熔点高,钠作耐火材料(砖),人造刚玉,也能冶炼铝等。根据原子守恒可知,方程式为4Al+3TiO2+3C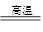 2Al2O3+3TiC。
2Al2O3+3TiC。
本题难度:一般
4、简答题 有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为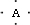
,B原子L层的电子总数是K层的3倍;0.1mol?C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A______,B______,C______,D______.
(2)D元素在周期表中属第______周期______族.
(3)用电子式表示A的气态氢化物的形成过程:______.
(4)A和B的单质充分反应生成化合物的电子式是______.
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明______;______.
参考答案:答案:(1)B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol?C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,故答案为:碳,氧,镁,铝;
(2)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期ⅢA族,
故答案为:三,ⅢA;
(3)A的气态氢化物为CH4,用电子式表示形成过程为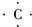
+4H?→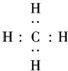
,故答案为: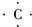
+4H?→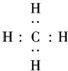
;
(4)A和B的单质充分反应生成化合物为CO2,电子式为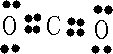
,故答案为: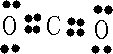
;
(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
故答案为:离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物.
本题解析:
本题难度:一般
5、填空题 决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为 ?。
(2)甲醛(H2C=O)分子碳原子的杂化方式为 ?用价层电子对互斥理论推断甲醛中H—C—H的键角?120o(填“>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是?。
(4)设MgO晶胞的边长为acm,则MgO的密度是?g·cm-3(只要求列算式。阿伏加德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有??(填字母)。
A.离子键
B.共价键
C.金属键
D.配位键 E.氢键 F.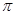 键
键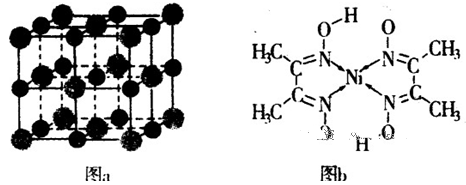
参考答案:(1)N>O>S;(2)sp2;<;(3)MgO>CaO>KCl;(4)160/a3NA;(5)AC。
本题解析:(1)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S;(2)甲醛(H2C=O)分子碳原子的杂化方式为sp2;甲醛(H2C=O)分子中氧原子上含有两对孤对电子,对成键电子对有排斥作用,甲醛中H—C—H的键角<120o;(3)对于结构相似的离子晶体,晶格能越大晶体的熔点越高;晶格能的高低取决于离子半径和离子所带的电荷,离子半径越小,所带电荷越多,晶格能越大,熔点越高;则KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是MgO>CaO>KCl;(4)根据MgO晶胞结构利用切割法分析知,1mol晶胞中含有4molMgO,质量为160g,晶胞的边长为acm,则1mol晶胞的体积为a3NAcm3则MgO的密度是160/a3NAg·cm-3;(5)根据配合物的分子结构判断,其分子内不含有离子键和金属键,选AC。
本题难度:一般