时间:2017-08-06 11:32:22
1、简答题 下图是周期表的一部分,A、B、C、D、E?5种元素的原子核外共含有80个质子.
| D | A B C E |
参考答案:(1)由元素所在周期表位置可推断元素位于二、三、四周期,设B的原子序数为x,则A的原子序数为x-1,C的原子序数为x+1,D的原子序数为x-8,E的原子序数为x+18,则有x+x-1+x+1+x-8+x+18=80,x=14,所以A为Al元素,B为Si元素,C为P,D为C元素,E为Ge元素,
故答案为:Al;Si;P;C;Ge;
(2)A、B、C对应最高价氧化物的水化物分别为Al(OH)3、H2SiO3、H3PO4,同周期元素从左到右元素的非金属性逐渐增强,则对应的最高价氧化物的水化物的酸性逐渐增强,则有酸性:H3PO4>H2SiO3>Al(OH)3,故答案为:H3PO4>H2SiO3>Al(OH)3;
(3)A的最高价氧化物对应的水化物为Al(OH)3,为两性氧化物,既能与酸反应生成盐和水,又能与碱反应生成盐和水,反应的离子方程式分别为Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O,
故答案为:两性;Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O;
(4)E为金属元素Ge,位于金属元素和非金属元素分界线附近,为良好的半导体材料,
故答案为:金属;半导体;在周期表中处在金属元素和非金属元素分界线附近.
本题解析:
本题难度:一般
2、填空题 ( 13分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
| ?分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 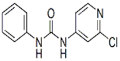 | 白色结晶粉末 | 170~172°C | 易溶于水 |
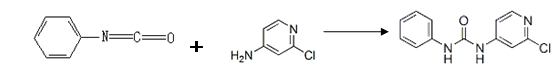 异氰酸苯酯? 2-氯-4-氨基吡啶?氯吡苯脲
异氰酸苯酯? 2-氯-4-氨基吡啶?氯吡苯脲参考答案:(13分)(1)1?(1分)?(2)分子晶体? N> O> C?(各1分,共2分)
(3)sp2、sp3?(各1分,共2分)?(4)C、D?(各1分,共2分)
(5)氯吡苯脲是分子晶体,故熔点低;氯吡苯脲与水分子间形成氢键,故易溶于水。(各1分,共2分)
(6)NA(或6.02×1023)? NA(或6.02×1023)(各1分,共2分)
本题解析:(1)根据构造原理可知,氯元素基态原子核外电子的排布式是1s22s22p63s23p5,所以未成对电子数为1个。
(2)氯吡苯脲的熔点较低,易溶于水,所以其晶体类型是分子晶体。其中所含第二周期元素分别是C、N、O,非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的,即正确的顺序是N>O>C。
(3)根据结构简式可知,2个氮原子全部形成单键,属于sp3杂化。另外一个氮原子形成双键,所以是sp2杂化。
(4)氯吡苯脲分子中全部是非金属元素构成的,含有共价键。另外氮原子和氧原子都含有孤对电子,所以还能形成配位键,答案选CD。
(5)由于氯吡苯脲是分子晶体,所以熔点低;另外氯吡苯脲还能与水分子间形成氢键,所以还易溶于水。
(6)由于单键都是σ键、而双键是由1个σ键和1个π键构成的,所以根据反应的方程式可知,每生成1mol氯吡苯脲,断裂NA个σ键和NA个π键。
点评:在判断杂化轨道类型时,应该通过化学键进行,即sp3杂化全部形成单键,sp2杂化中还有1个双键,而sp杂化中还有1个三键。
本题难度:一般
3、选择题 2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是(? )
A.CBr2F2
B.CH3CH2OH
C.CH3CH2CH3
D.CH3CH(OH)COOH
参考答案:D
本题解析:略
本题难度:简单
4、简答题 四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题.
| 元素 | A | B | C | D 性质 结构 信息 室温下单质是粉末状固体,加热易熔化. 单质在空气中燃烧生成的气体是形成酸雨的主要污染物之一. 单质常温、常压下是黄绿色气体,能溶于水. 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. 原子最外层电子层上s电子数等于p电子数. 单质是一种常见的半导体材料. |
参考答案:A、B、C、D是短周期四种元素,A单质室温下单质是粉末状固体,加热易熔化.单质在空气中燃烧生成的气体是形成酸雨的主要污染物之一,则A为S元素;
B单质常温、常压下是黄绿色气体,能溶于水,则B为Cl元素;
C单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰.则C为Na元素;
D原子最外层电子层上s电子数等于p电子数.单质是一种常见的半导体材料.则D为Si元素,即A为S元素,B为Cl元素,C为Na元素,D为Si元素.
(1)B为Cl元素,处于第三周期第ⅦA族;A为S元素,原子核外有16个电子,核外电子排布式为1s22s22p63s23p4,
故答案为:第三周期第ⅦA族;1s22s22p63s23p4;
(2)C为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为2Na+2H2O═2NaOH+H2↑;
A为S元素,A与C形成的化合物为硫化钠,为强碱弱酸盐,溶于水后硫离子发生水解,溶液呈碱性,溶液的pH大于7,
故答案为:2Na+2H2O═2NaOH+H2↑;大于;
(3)D为Si元素,最高价氧化物为SiO2,SiO2与氢氧化钠溶液反应的离子方程式为SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(4)A为S元素,B为Cl元素,同周期自左而右,非金属性减弱,所以非金属性Cl>S;
高氯酸的酸性强于硫酸的酸性,氯化氢的稳定性强于硫化氢,氯气氧化硫化氢为硫单质,都说明非金属性Cl>S,
故答案为:Cl;高氯酸的酸性强于硫酸的酸性或氯化氢的稳定性强于硫化氢或氯气氧化硫化氢为硫单质.
本题解析:
本题难度:一般
5、选择题 六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是
[? ]
A.10?
B.12?
C.24?
D.28
参考答案:B
本题解析:
本题难度:简单