时间:2017-08-06 11:15:35
1、选择题 目前世界上最重要的气态化石燃料是( ? )
A.水煤气
B.一氧化碳
C.天然气
D.氢气
2、选择题 实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂.发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
A.Fe3O4和FeO
B.MnO2和V2O5
C.Cr2O3和V2O5
D.Fe2O3和MnO2
3、填空题 二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在)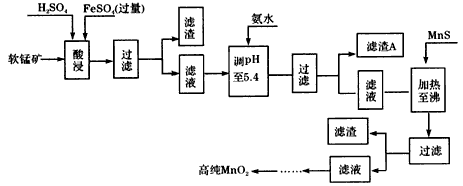
某软锰矿的主要成分为MnO2,还含Si(16. 27%)、Fe(5. 86%)、Al(3. 24%)、Zn (2.68%)和Cu(0. 86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题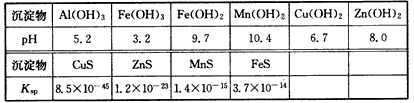
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为_________________。
(2)滤渣A的主要成分为__________。
(3)加入MnS的目的是除去__________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为_______________。
(5)从废旧碱性锌锰电池中可回收利用的物质有_______________(写两种)。
4、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有 少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分 数为97.0%~103.0%)的主要流程如下: 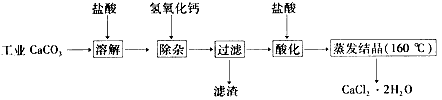
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0一8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量 Ca( OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③____。
(3)测定样品中Cl-含量的方法是:a称取0.7500 g样品,溶解在250 mL容量瓶中定容;b量取25.00 mL待测溶液于锥形瓶中;c用0.05000 moI/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20. 39 mL。
①述测定过程中需用溶液润洗的仪器有_______________ 。
②计算上述样品中CaCl2·2H2O的质量分数为___________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有___________________________;_____________________ 。
5、填空题 新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。 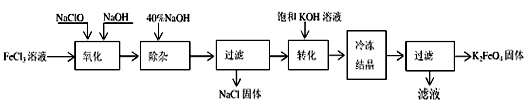
(1)写出“氧化”过程中反应的离子方程式:___________________________。
(2)写出“转化”过程中发生反应的化学方程式为_______________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用__________溶解,然后____________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为_________________________。