时间:2017-08-06 10:47:19
1、填空题 常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表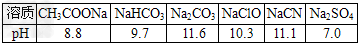
(1)上述盐溶液中的阴离子,结合质子能力最强的是______
(2)根据表中数据,浓度均为0.01mol·L-1的下列五种物质的溶液中,酸性最强的是______(填字母);将各溶液分别稀释100倍,pH变化最小的是______(填字母)
A.HCN B.HClO C.H2SO4 D.CH3COOH? E.H2CO3
参考答案:(1)CO32-
(2)C;A
本题解析:
本题难度:一般
2、选择题 物质的量浓度相同的下列溶液中,符合PH由小到大顺序排列的是( )
A.Na2CO3?NaHCO3?NaCl?NH4Cl
B.NaHCO3Na2CO3?NH4Cl?NaCl
C.NH4Cl?(NH4)2SO4?Na2S?NaNO3
D.(NH4)2SO4?NH4Cl?NaNO3?Na2S
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列对于溶液中的问题叙述正确的是
[? ]
A.向冰醋酸中加水至配成醋酸稀溶液的过程中,H+的浓度逐渐减小
B.对于水的电离而言,加入强酸、强碱会促进水的电离,而加入弱酸、弱碱则会抑制水的电离
C.5 mL 0.02 mol/LHCl溶液与5 mL 0.02 mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10 mL,则溶液的pH=12
D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO -)的情况
参考答案:C
本题解析:
本题难度:一般
4、填空题 25℃时,有浓度均为0. 10 mol/L的两种溶液:①NaCl溶液、②CH3COONa溶液。请回答:
(1)两种溶液中,pH>7的是___(填“①”或“②”),其原因是___ (用离子方程式表示)。
(2)下列说法正确的是____(填序号)。
①CH3COONa是弱电解质
②NaCl和CH3COONa都能促进水的电离
③两种溶液等体积混合后,溶液中离子浓度大小关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
(3)若电解1.00 L饱和NaCl溶液,收集到1.12 L H2(标准状况),则此时溶液的pH为 ____(不考虑溶液体积的变化)。
参考答案:(1)②; CH3COO- +H2O CH3COOH+OH-
CH3COOH+OH-
(2)③
(3)13
本题解析:
本题难度:一般
5、选择题 25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
[? ]
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c( OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
参考答案:C
本题解析:
本题难度:一般